Cellulært kraftværk genbruger affaldsgasser
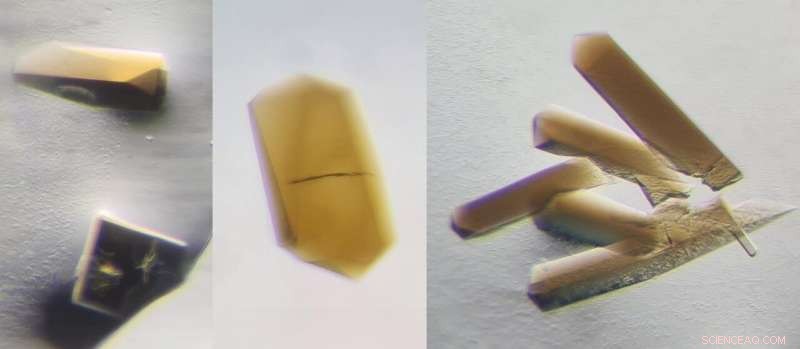
CODH/ACS-krystaller opnået uden oxygen. Den brune farve kommer fra de naturlige metaller, som proteinerne rummer. Kredit:Max Planck Institute for Marine Microbiology/T. Wagner
Affaldsgasser fra mange industrigrene indeholder hovedsageligt kulilte og kuldioxid. I dag, disse gasser blæses simpelthen ind i vores atmosfære, men dette kan snart ændre sig. Idéen er at bruge bakteriernes kraft til at omdanne giftige affaldsgasser til værdifulde forbindelser såsom acetat eller ethanol. Disse kan efterfølgende bruges som biobrændstoffer eller basisforbindelser til syntetiske materialer. De første testanlæg i virkelig størrelse er allerede under evaluering, ved at bruge denne konvertering i industriel skala, og stjernerne i disse processer er bakterier, der fortærer kulilte, kuldioxid og dihydrogen, blandt hvilke Clostridium autoethanogenum er langt favoritten.
"I denne mikrobe, hovedlinjerne i metabolismen, der bruges til at drive gasomdannelsen, er blevet karakteriseret, siger Tristan Wagner, leder af gruppen Microbial Metabolism ved Max Planck Institute for Marine Microbiology. "Men der er stadig mange spørgsmålstegn på molekylært niveau." Den, der er i fokus for videnskabsmændene fra Bremen:Hvordan behandles det giftige kulilte af enzymer med så forbløffende effektivitet?
Stor overraskelse i en krystal
Den molekylære viden om kulilteomdannelsen er afledt af undersøgelser udført i arten Moorella thermoacetica. Dette er en bekvem og velundersøgt marin modelorganisme, men udviser en dårlig evne til at afgifte affaldsgasser, i modsætning til Clostridium autoethanogenum. Begge bakterier bruger det samme enzym til at omdanne kulilte:CO-dehydrogenase/acetyl-CoA-syntasen, forkortet som CODH/ACS. Det er et meget almindeligt enzym, som eksisterede allerede i jordens urtid. "Da begge arter bruger det samme enzym til at omdanne kulilte, vi forventede at se nøjagtig den samme struktur med til sidst mindre forskelle, siger Wagner.
For deres forskning, Wagner og hans kollega Olivier N. Lemaire studerer bakterien Clostridium autoethanogenum for at forstå, hvordan den kan trives ved livets termodynamik, ved hjælp af et stofskifte svarende til det i de første levende former. Olivier N. Lemaire dyrkede bakterierne og rensede dens CODH/ACS i fravær af ilt, hvilket er skadeligt for enzymet. De to videnskabsmænd brugte krystallisationsmetoden til at opnå krystaller af enzymet CODH/ACS og bestemme proteinets 3-D-struktur ved røntgenkrystallografi. "Da vi så resultaterne, vi kunne ikke tro vores egne øjne, " siger Wagner. "CODH-ACS-grænsefladen fra Clostridium autoethanogenum adskiller sig drastisk fra modellen af Moorella thermoacetica, selvom det var det samme enzym og lignende bakterier."
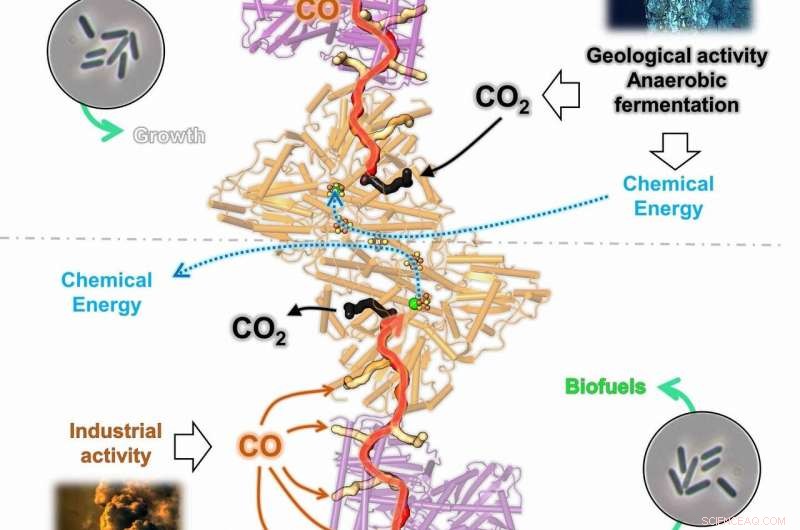
Grafisk viser todirektionaliteten af CODH/ACS-komplekset fra C. autoethanogenum (CODH i orange og ACS i lilla). Under kemolitoautotrofe forhold, enzymet kan omdanne kuldioxid (CO2) til kulilte (CO), sekvestreret i en gaskanal (øverst). CO vil blive omdannet til acetyl-CoA, byggestenen i cellen, der bruges til at opnå cellulær energi og bygge cellematerialet. Under gaskonverteringsprocessen, CODH frigivet ved industriel aktivitet kan meget effektivt bruges af CODH/ACS (nederst). Det fanges af de mange gaskanaler og vil generere Acetyl-CoA og kemisk energi på samme tid, lader cellen skabe et liv ud af CO. Kredit:O. Lemaire og T. Wagner. Det anvendte ikke-ophavsretligt beskyttede billede blev hentet fra National Oceanic and Atmospheric Administration (NOAA) og Pexel fotobibliotek (Black Smoker; NOAA Office of Ocean Exploration and Research, 2016 Dybvandsudforskning af Marianerne; Fabriksfotografering af Chris LeBoutillier
Samme ingredienser, anderledes arkitektur
Bagefter, de to forskere udførte yderligere eksperimenter for at bevise, at den første struktur ikke var en artefakt, men den biologiske virkelighed. Følgende eksperimenter bekræftede den oprindelige model. Dermed, opdagelsen beviser klart forkert den tidligere antagelse om, at enzymet CODH/ACS altid har den samme overordnede struktur. "Enzymet af Moorella thermoacetica har en lineær form, " forklarer Olivier N. Lemaire, første forfatter til undersøgelsen, som for nylig blev offentliggjort i det videnskabelige tidsskrift BBA Bioenergetics . "I Moorella thermoacetica, enzymet producerer kulilte i CODH og bruges i ACS. Mellem dem, det fanges og ledes gennem en forseglet gaskanal. ACS vil i sidste ende syntetisere acetyl-CoA, en byggesten videreforarbejdet til acetat og ethanol. Resten af cellen ser ikke noget kulilte."
Men Clostridium autoethanogenum absorberer kulilte direkte. "I Clostridium autoethanogenum har enzymet CODH/ACS ikke kun én åbning, men flere. På denne måde kan den opsamle så meget kulilte som muligt og lede det ind i et helt system af tunneler, opererer i begge retninger, " siger Lemaire. "Disse resultater viser en omrokering af interne gastunneler under udviklingen af disse bakterier, formodentlig fører til et tovejskompleks, der sikrer en høj flux af kulilteomdannelse mod energibevarelse og assimilering af kulilte, fungerer som det primære cellulære kraftværk." Ved slutningen af processen genereres også acetat og ethanol, som kan bruges til at producere brændstoffer.
"Vi har nu et billede af, hvordan dette meget effektive og robuste enzym ser ud, " siger Tristan Wagner. "Men vores opdagelse er kun et skridt videre. Blandt andet, det er stadig et åbent spørgsmål, hvordan bakterien kan overleve og bruge kulilte til at brødføde hele deres cellulære energibehov. Vi har nogle hypoteser, men vi er stadig i begyndelsen. For at forstå hele den kemiske proces med at omdanne carbonmonoxid til acetat og ethanol, yderligere proteiner skal undersøges."
 Varme artikler
Varme artikler
-
 Ny ramme anvender maskinlæring til atomistisk modelleringKredit:Pixabay/CC0 Public Domain Forskere fra Northwestern University har udviklet en ny ramme ved hjælp af maskinlæring, der forbedrer nøjagtigheden af interatomiske potentialer - de vejledende
Ny ramme anvender maskinlæring til atomistisk modelleringKredit:Pixabay/CC0 Public Domain Forskere fra Northwestern University har udviklet en ny ramme ved hjælp af maskinlæring, der forbedrer nøjagtigheden af interatomiske potentialer - de vejledende -
 Sådan koges havvand til drikkeFor at gøre havvand drikkeligt, behøver du ikke kun at sterilisere det, du skal også fjerne saltet. At drikke store mængder havvand kan være dødbringende på grund af den belastning, det lægger på dine
Sådan koges havvand til drikkeFor at gøre havvand drikkeligt, behøver du ikke kun at sterilisere det, du skal også fjerne saltet. At drikke store mængder havvand kan være dødbringende på grund af den belastning, det lægger på dine -
 Farvekodning af molekylære spejlbillederOrganiske farveindikator-forbindelser bestående af enhånds spiralformede poly(diphenylacetylen)er med carboxygrupper i sidekæderne (M–h-poly-1-H) til at skelne mellem enantiomerer af chirale aminer og
Farvekodning af molekylære spejlbillederOrganiske farveindikator-forbindelser bestående af enhånds spiralformede poly(diphenylacetylen)er med carboxygrupper i sidekæderne (M–h-poly-1-H) til at skelne mellem enantiomerer af chirale aminer og -
 Vegetabilske proteiner erstatter petroleumsbaserede råvarerRapsmark i blomst:Raps er det mest dyrkede oliefrø i Tyskland – det er på tredjepladsen på verdensplan efter oliepalme og soja. Kredit:Alexas_Fotos/pixabay.com Ligesom cellulose, lignin og fedtsto
Vegetabilske proteiner erstatter petroleumsbaserede råvarerRapsmark i blomst:Raps er det mest dyrkede oliefrø i Tyskland – det er på tredjepladsen på verdensplan efter oliepalme og soja. Kredit:Alexas_Fotos/pixabay.com Ligesom cellulose, lignin og fedtsto
- Et gennembrud inden for udvikling af multi-watt terahertz-lasere
- Koncentriske cirkulære polariseringsbånd fundet i en ferroelektrisk polymer
- Hvad er hypertonisk opløsning?
- De bedste isolatorer til at holde vandet varmt
- Udvikling af en kritisk model til at skabe bedre enheder
- Opdagelse af enkelte molekyler og diagnosticering af sygdomme med en smartphone


