Studer polyfarmakologi tidligere i lægemiddelopdagelsen, siger forskere
Kredit:CC0 Public Domain
Polyfarmakologi - et lægemiddels evne til at påvirke mere end ét protein - bør studeres tidligt i lægemiddelopdagelsesforløbet, og konstant overvåget, da den kemiske struktur er optimeret i designet af den kliniske kandidat, mener førende forskere.
Ny forskning viser vigtigheden af at vurdere polyfarmakologi fra starten for at undgå uønskede effekter uden for mål eller potentielt i fremtiden endda for bevidst at ramme to eller flere ønskede mål på én gang.
Den nye undersøgelse foretaget af forskere ved Institut for Kræftforskning, London, brugte beregningsmæssige og eksperimentelle tilgange til at undersøge polyfarmakologien af en klasse af lægemidler kaldet Hsp90-hæmmere, at bestemme, om disse hæmmere også påvirker en anden gruppe af proteiner, nemlig kinaser.
Forskningen viste potentialet for, at polyfarmakologien af et prototypelægemiddel kan ændre sig, da det er optimeret til aktivitet mod et bestemt protein gennem lægemiddelopdagelsesrejsen - og forstærkede vigtigheden af at holde et omhyggeligt spor af, hvilke yderligere proteiner et lægemiddel rammer fra starten. .
Lægemidler med betydelig polyfarmakologi risikerer at være mindre specifikke i deres virkning på celler end dem, der kun rammer et enkelt protein. Konsekvenserne af virkninger uden for mål er svære at forudsige og kan omfatte uventede bivirkninger og vanskeligheder med at forstå et lægemiddels reelle virkningsmekanisme. eller potentielt kunne øge effektiviteten af et lægemiddel, hvis det var i stand til at ramme flere kræftmål.
Undersøgelse af Hsp90-hæmmere
Forskere ved ICR screenede Hsp90-hæmmere mod meget store antal kinaser - ved hjælp af både computerbaserede og eksperimentelle metoder - i forskning offentliggjort i Cellekemisk biologi og stort set finansieret af Wellcome.
Selvom disse inhibitorer oprindeligt blev designet til at hæmme aktiviteten af et kræftfremkaldende protein, Hsp90, forskerne fandt ud af, at nogle af stofferne var 'multi-tasking', " påvirker flere kinaser såvel som Hsp90. De viste også, at de påvirkede kinaser ændrede sig uventet under optimeringen af et af lægemidlerne.
Hsp90 er en proteinchaperon - hvilket betyder, at det hjælper andre "klient"-proteiner med at folde korrekt i cellen - og er derfor afgørende for, at mange biologiske systemer fungerer korrekt.
Hsp90 arbejder med hundredvis af klientproteiner, herunder flere potentielle kræftlægemiddelmål og også proteiner involveret i Alzheimers sygdom og virale proteiner fra SARS-CoV-2. Hsp90-hæmmere er gået ind i kliniske forsøg til behandling af kræft og også for Alzheimers sygdom og COVID-19.
Forudsige effekter uden for målet
I det nye værk, forskerne undersøgte seks forskellige Hsp90-hæmmere fra forskellige kemiske familier. To lægemidler i klinisk fase, ganetespib og luminespib, viste betydelige effekter uden for målet, hvilket betyder, at de påvirkede kinaser såvel som Hsp90.
Forskerne brugte beregningsmetoder til at forudsige kinasepolyfarmakologien for alle seks inhibitorer og bekræftede mange af forudsigelserne gennem eksperimentel laboratorieanalyse i stor skala. Luminespib og ganetespib viste off-target effekter på flere kinaser, herunder nogle kendt for at være involveret i kræftudvikling.
Kinaser flytter fosfatgrupper til proteiner, påvirker proteinets aktivitet. De spiller en nøglerolle i stofskiftet såvel som cellesignalering og er faktiske eller potentielle mål for mange kræftlægemidler.
Vigtigt, de beregningsmæssige 'in silico'-metoder forudsagde halvdelen af de off-target-effekter fundet i laboratoriet for både ganetespib og luminespib - hvilket understreger anvendeligheden af beregningsbiologi i lægemiddelforskningsstudier af denne type.
Udvikling af polyfarmakologi
For luminespib, den oprindelige "hit"-forbindelse og to "bly"-forbindelser - tidligere iterationer af det kemiske molekyle, der blev til stoffet - er offentligt tilgængelige, og så var forskerne også i stand til at studere, hvordan off-targets udviklede sig under opdagelsen af dette lægemiddel.
Forskerne fandt ud af, at luminespibs off-target-effekter ændrede sig betydeligt, efterhånden som molekylet blev optimeret. uventet, det sidste lægemiddel, luminespib, havde betydeligt flere off-targets end blyforbindelserne, og disse inkluderede kinaser, der ikke var påvirket af den oprindelige hitforbindelse.
Konstateringen af, at et lægemiddels polyfarmakologi kan ændre sig i løbet af lægemiddelopdagelsen, tyder på, at virkninger uden for mål bør overvåges fra et meget tidligere stadium og derefter gennem hele projektet.
Forskerne fremlagde også bevis for, at Hsp90-hæmmere kunne binde til kinaser i levende celler.
Forskerne mener, at forståelsen af et lægemiddels polyfarmakologi vil være afgørende for at kunne undersøge og etablere dets virkningsmekanisme korrekt. Det skal være muligt at designe uønskede effekter uden for mål, eller potentielt i fremtiden kan lægemidler designes til bevidst at ramme to eller flere ønskede mål på én gang, for at give et stærkere slag end blot at ramme et enkelt protein.
Studielederforfatter Dr. Albert Antolin, Sir Henry Wellcome Postdoctoral Fellow ved Institute of Cancer Research, London, sagde,
"Et lægemiddels polyfarmakologi kan påvirke den virkning, det har på celler, og måden det fungerer på som behandling. Vi fandt, til vores overraskelse, at polyfarmakologien af lægemiddelkandidater skabt for at målrette proteinchaperonen Hsp90 ændrede sig under lægemiddelopdagelsesrejsen - med senere versioner af lægemidlet, der genvandt off-target-effekter, og får også nye effekter, der adskiller sig fra tidligere iterationer.
"Vores undersøgelse understreger vigtigheden af at undersøge virkninger uden for målet tidligere i lægemiddelopdagelsen, at være opmærksom på potentielle negative virkninger, og måske endda for at kunne udnytte fordelene ved off-target effekter. Det demonstrerer også den voksende værdi af in silico, beregningsmetoder i lægemiddelopdagelse."
Beregningsmæssige forudsigelser
Studie medleder professor Bissan Al-Lazikani, Leder af datavidenskab ved Institut for Kræftforskning, London, sagde:
"Det systematiske studie af polyfarmakologi skal blive en afgørende del af lægemiddelopdagelsen. Efterhånden som beregningsmæssige tilgange bliver ved med at blive bedre, vi kan bedre forudsige, hvordan lægemidler vil opføre sig på tværs af hele proteomet, med en mulighed for meget bedre at forstå, hvordan de udøver deres virkninger på celler.
"Vores nye forskning understreger potentialet ved beregningsteknikker til at hjælpe med at opdage effekter uden for mål, der kan interferere med et lægemiddels specificitet, og åbner endda op for fremtidige muligheder for at designe 'multi-tasking' lægemidler, der rammer mere end ét mål involveret i sygdom."
Studiemedleder professor Paul Workman, administrerende direktør for Institut for Kræftforskning, London, sagde:
"På ICR er vi dybt interesserede i, i hvilket omfang lægemidler og kemiske værktøjsforbindelser, vi bruger i laboratoriet, er i stand til at interagere med andre proteiner, ud over det primære interessemål.
"Det er vigtigt at være i stand til at forudsige og karakterisere disse mål for at forstå præcis, hvordan lægemidler og kemiske prober virker i celler og også for at lære, hvordan man kontrollerer denne multi-tasking adfærd for at maksimere den terapeutiske fordel for patienterne og minimere bivirkninger.
"Vores nuværende resultater giver et vigtigt casestudie, som vi og andre forskere kan lære af til fremtidig lægemiddeldesign."
Sidste artikelNanomaterialer med laserprint
Næste artikelMagnetisk materialeanalyse har aldrig været så forståelig
 Varme artikler
Varme artikler
-
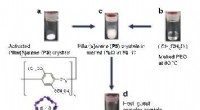 Valg af molekylvægtspolymer ved endimensionel indeslutningFigur 1. Vært-gæst kompleks dannelse mellem en krystal af aktiverede søjle[5]arener og en poly(ethylenoxid) smelte. Kredit:Kanazawa University Forskere ved Kanazawa University rapporterer i Natur
Valg af molekylvægtspolymer ved endimensionel indeslutningFigur 1. Vært-gæst kompleks dannelse mellem en krystal af aktiverede søjle[5]arener og en poly(ethylenoxid) smelte. Kredit:Kanazawa University Forskere ved Kanazawa University rapporterer i Natur -
 Enhed forvandler skaller af havdyr til kraft til medicinsk, augmented reality, mobiltelefonenhederEt Purdue-team er ved at omdanne rejeskalmateriale til en funktionel enhed til at generere elektricitet. Kredit:Purdue University En innovation, der bruger materiale, der stammer fra skaller fra k
Enhed forvandler skaller af havdyr til kraft til medicinsk, augmented reality, mobiltelefonenhederEt Purdue-team er ved at omdanne rejeskalmateriale til en funktionel enhed til at generere elektricitet. Kredit:Purdue University En innovation, der bruger materiale, der stammer fra skaller fra k -
 Forskere finder en måde at skabe lang levetid, hurtigopladelige batterierKredit:CC0 Public Domain En gruppe forskere under ledelse af Skoltech -professor Pavel Troshin undersøgte koordineringspolymerer, en klasse af forbindelser, der næsten ikke er undersøgt i metalion
Forskere finder en måde at skabe lang levetid, hurtigopladelige batterierKredit:CC0 Public Domain En gruppe forskere under ledelse af Skoltech -professor Pavel Troshin undersøgte koordineringspolymerer, en klasse af forbindelser, der næsten ikke er undersøgt i metalion -
 Hvilke mineraler er i en pære?Pærer består af et antal ikke-metalliske mineraler og metalliske mineraler samt forskellige andre periodiske gasser og ikke-mineraliske materialer. Mange af disse mineraler findes i overflod i natu
Hvilke mineraler er i en pære?Pærer består af et antal ikke-metalliske mineraler og metalliske mineraler samt forskellige andre periodiske gasser og ikke-mineraliske materialer. Mange af disse mineraler findes i overflod i natu
- Meget effektiv, højeffekt kort-puls lasere baseret på Tm3+ dopede materialer
- NASA analyserer nye østlige Stillehavet Tropical Depression 7E
- US ATLAS fase I -opgradering afsluttet
- Alsidig sensor mod tumorinitierende celler
- Fødevaretilsætningsstof fundet i slik, tyggegummi kan ændre fordøjelsescellernes struktur og fun…
- Perfekt stormskib sænket, bliver en del af kunstigt rev


