Sammenligning af kryogene strukturer med stuetemperaturprøver kan hjælpe med at identificere fejl i beregningsmodeller
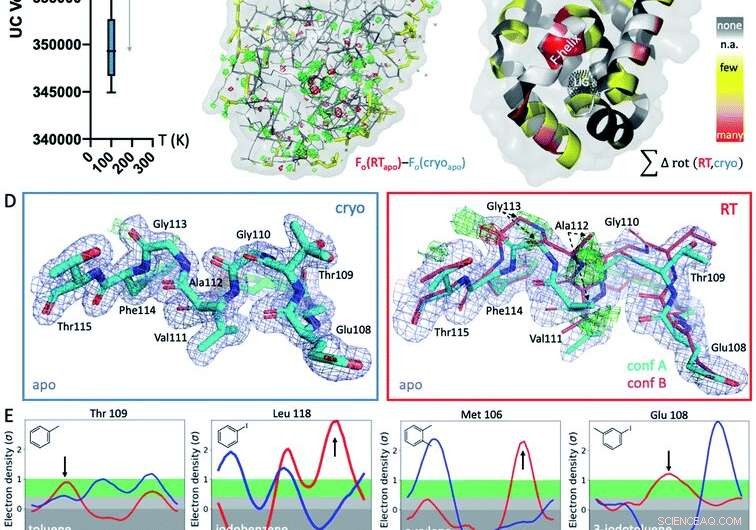
Fig. 1 Globale og lokale strukturelle reaktioner på temperatur. (A) Globalt, strukturer ved kryogene temperaturer (cryo; blå plot) er mere variable og mere kompakte end deres stuetemperatur (RT; røde plot) ækvivalenter, som vist ved gennemsnitlige enhedscelle (UC) mængder på tværs af 9 matchede strukturer opsamlet ved begge temperaturer. (B) Det isomorfe Fo - Fo -kort over apo -strukturen indsamlet ved kryo versus RT viser forskelle i elektrontætheden (grønt net, positiv forskel elektrontæthed; rød maske, negativ forskel elektrontæthed), der angiver særegne temperatureffekter, især omkring ligandbindingsstedet i bundloben, angivet med det sorte prikkede net i panel C (mærket LIG). (C) Forekomst af temperaturafhængige rotamerforskelle på tværs af alle 9 strukturer projiceres på de respektive rester i T4L apo-strukturen; farvet af temperaturfølsomhed for hver rest på tværs af alle 9 strukturpar:gul for få strukturer, orange til flere strukturer, og rød for de fleste strukturer, der viser temperaturforskelle i remanensen; hvide pletter er Gly og Ala, der ikke har Chi -vinkler; og grå pletter viser ingen rotamerændring med temperaturen. (D) lokalt, RT-data for L99A apo-hulrummet afslører en alternativ F-helix-konformation (konf. B) i Fo-Fc-forskellens elektrontæthedskort (grøn og rød maske til positiv og negativ densitet, henholdsvis; kun cyanformation A var inkluderet i forfining), der ikke er synlig ved kryo; 2mFo - DFc -kort vist som blåt net; stoktykkelse repræsenterer relativ belægning. (E) Alle 8 ligandkomplekser viser et skift i foretrukken orientering som reaktion på temperatur snarere end på grund af ligandbinding for mindst 1 restrotamer i F-helix nær ligandbindingsstedet. Ringerplots for udvalgte rester, med rotamerforskelle ved RT (rød) versus cryo (blå) angivet med pile. Kredit:DOI:10.1039/D1SC02751D
Omkring 95% af alle krystalstrukturer opnået for forskellige proteiner og deponeret i offentlige databaser fanges ved hjælp af kryogen teknologi. Denne teknologi kræver frosne forhold. Forskere ved St. Jude Children's Research Hospital sammenlignede kryogene strukturer med dem, der blev observeret ved stuetemperatur. Fundene, udgivet i dag i Kemisk videnskab , angive, at indefrysning kan medføre fejl, forårsage, at visse konformationer (former) savnes og føre til unøjagtigheder i beregningsmodeller.
Proteinstrukturer er afgørende for lægemiddeludviklingsprocessen, fordi de giver et kort over, hvordan målrettede lægemidler skal udformes.
"Vi er nødt til at genoverveje, hvordan vi indsamler, analysere og udnytte strukturel information, når vi sætter os for at opdage bioaktive molekyler, "sagde den tilsvarende forfatter Marcus Fischer, Ph.d., St. Jude Institut for Kemisk Biologi og Terapeutik. "Du kan se temperaturen som en eksperimentel knop, vi kan dreje for at udforske skjulte proteinkonformationer."
Temperaturen gør hele forskellen
Forskerne har vist, at frysning forvrænger de konformationer, proteiner tager, indfører ofte fejl i strukturer. Holdet fandt også, at nogle konformationer, der forekommer ved stuetemperaturforhold, kan gå glip af, hvis man kun ser på resultater fra kryogene teknikker.
Forskerne foretog en systematisk evaluering af kryogene strukturer, startende med T4 lysozym L99A hulrum. Dette protein betragtes som en "arbejdshest" i strukturbiologi for at forstå proteinstabilitet, stivhed og ligandbindende termodynamik. Skift til stuetemperatur afslørede nye strukturelle ændringer, der har været savnet i årtier.
Holdet testede yderligere fire proteinklasser. Resultaterne holdt stik, uanset hvilken type protein der blev evalueret.
"Når du går ud om vinteren og er kold, du komprimerer og krymper dig selv, og i solen når du er varm strækker du dig ud. Proteiner gør det samme, "Sagde Fischer.
Undgå fejl
Beregningsmetoder er algoritmer, som forskere bruger til at komme med forudsigelser eller evaluere data fra deres eksperimenter. Resultaterne indikerer, at når disse metoder er bygget på data fra kryogene strukturer, der kan indføres fejl, der kan forringe fremtidige resultater.
Kryogene teknikker har længe været foretrukket, fordi de gør det lettere at få strukturerne. At få strukturer ved stuetemperatur er mere kedeligt. Selvom der er måder at afbøde disse problemer, faktorer som datafuldstændighed og strålingsskader er yderligere forhindringer for mange forskere i at opnå rumtemperaturstrukturer.
Selvom detektering af en skjult proteinform er informativt, viser den nye forms indvirkning på protokoller for opdagelse af lægemidler manglede stadig.
"Vi så, at proteinet vedtog en tilstand for at interagere med ligander, og at manglende information kan hjælpe med at forbedre nøjagtigheden af virtuelle lægemiddelscreeninger og protein-ligand-interaktionssimuleringer, "sagde den første forfatter Shanshan Bradford, Ph.d., St. Jude Institut for Kemisk Biologi og Terapeutik.
Forskerne understreger, at når man bare overvejer kryogene strukturer, der er ingen måde at fortælle, om der er fejl, men denne sammenligning med rumtemperaturstrukturer kan hjælpe med at tydeliggøre oplysninger og potentielt afsløre yderligere indsigter, der ellers savnes.
Sidste artikelKunstig fotosynteseteknologi dukker op
Næste artikelNy jernbaseret katalysator øger omdannelsen af CO2 til højere alkoholer
 Varme artikler
Varme artikler
-
 Tekstil-baserede kompositter kan væve fremtiden for rumfartsteknikFlettemaskine. Kredit:University of Manchester Avanceret materialeforskning ved University of Manchester har vist et omfattende billede af udviklingen af skader i flettede tekstilkompositter for
Tekstil-baserede kompositter kan væve fremtiden for rumfartsteknikFlettemaskine. Kredit:University of Manchester Avanceret materialeforskning ved University of Manchester har vist et omfattende billede af udviklingen af skader i flettede tekstilkompositter for -
 Video:Hvordan slipper man af med den skunk lugt?Kredit:The American Chemical Society Skunks er natdyr, der foretrækker at holde sig for sig selv. Imidlertid, når de mærker fare, denne lurende leverandør af biokemisk krigsførelse frigiver sin p
Video:Hvordan slipper man af med den skunk lugt?Kredit:The American Chemical Society Skunks er natdyr, der foretrækker at holde sig for sig selv. Imidlertid, når de mærker fare, denne lurende leverandør af biokemisk krigsførelse frigiver sin p -
 Molekylært fyrtårn signalerer lavt iltindhold med ultralydIllinois -kandidatstuderende Hailey Knox og kemiprofessor Jefferson Chan udviklede en fotoakustisk molekylær sonde, der aktiveres i iltfattige væv, hvilket kan føre til bedre diagnose og behandling af
Molekylært fyrtårn signalerer lavt iltindhold med ultralydIllinois -kandidatstuderende Hailey Knox og kemiprofessor Jefferson Chan udviklede en fotoakustisk molekylær sonde, der aktiveres i iltfattige væv, hvilket kan føre til bedre diagnose og behandling af -
 Ammoniaksyntese - den største innovation i det 20. århundredeTilpasning af de innovationstrin, der er involveret i ammoniaksyntese. Kredit:A. Barona et al./ Sci. Eng. Etik (fotos fra Archiv der Max-Planck-Gesellschaft, Berlin Udover at være et velkendt reng
Ammoniaksyntese - den største innovation i det 20. århundredeTilpasning af de innovationstrin, der er involveret i ammoniaksyntese. Kredit:A. Barona et al./ Sci. Eng. Etik (fotos fra Archiv der Max-Planck-Gesellschaft, Berlin Udover at være et velkendt reng
- Maksimal kategori 5 orkan Iota tønder mod Mellemamerika
- Platinfri katalysatorer kunne lave billigere brintbrændselsceller
- Hvordan er sortbærer spredt?
- Kulstofoptagelse i tibetansk plateaujord kan opveje smeltende kulstoffrigivelse af permafrost
- Indiske domstol omstøder TikTok-apprestriktioner:rapport
- Copperhead Snake Identification i Virginia


