Udforsker, hvordan celler kan være stærke på det rigtige sted og på det rigtige tidspunkt
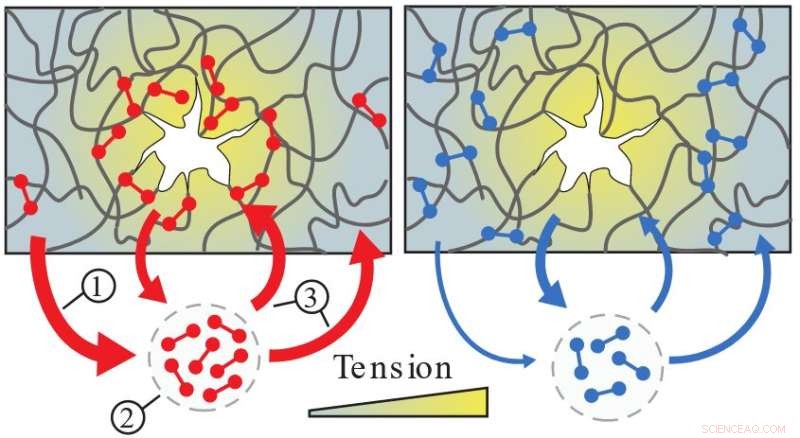
Catch bonds (rød) er svage i områder med lav spænding (1) og løsner derfor hurtigt (2). Disse ubundne binder igen på tilfældige steder i netværket, men binder kun tæt i højspændte områder (3), og forstærker derved netværket, hvor det er mest nødvendigt. I modsætning hertil forbliver normale bindinger (blå) fast i områder med lav spænding. Kredit:Forskerne
Forskere fra TU Delft og NWO-instituttet AMOLF opdagede, hvordan visse molekylære bindinger gør levende celler både fleksible, til at bevæge sig og stærke for at modstå kræfter. Paradoksalt nok viser det sig, at disse kraftfølsomme catch bonds er svage og inaktive det meste af tiden, men rejser til bestemte steder, hvor og når celler bliver beskadiget. Denne opdagelse blev offentliggjort i Nature Materials .
Molekylær catch bond proteiner kan findes i mange forskellige væv, både i og mellem celler. Disse bindinger falder jævnligt fra hinanden, som de fleste biologiske bindinger gør, men de har en ejendommelig egenskab:Hvis du trækker hårdt i en catch bond, begynder den faktisk at binde tættere. Forskere opdagede, at denne evne styrker materialet på bestemte steder, hvor bindingen oplever stress. Opdagelsen er et gennembrud, 20 år efter det første fund af sådanne obligationer. Det er også første gang, at forskerne har set fangstbindinger arbejde sammen inden for biologiske materialer.
Både fleksibel og stærk
Tidligere AMOLF-forsker Yuval Mulla forklarer, at "vi normalt definerer, hvor stærkt noget er på en af to måder:et materiale kan enten deformeres godt - strække sig meget langt uden at gå i stykker, såsom gummi - eller materialet kan bære meget kraft, for eksempel en mursten Selvom den er stærk, kan den kun strække sig lidt, før den går i stykker. Ved at studere arten af catch-bindinger fandt vi ud af, at disse molekylære bindinger var i stand til begge dele:være fleksible og stærke, selvom deres molekylære bindinger er svage. Og så vi overvejede:kan fangebindinger forklare, hvorfor levende celler kombinerer gummiets strækbarhed med styrken af en mursten?"
For at teste disse ideer målte forskerne de mekaniske egenskaber af cytoskeletnetværk, som de rekonstituerede i laboratoriet, i samarbejde med Biophysics-gruppen for at trække på enkeltbindinger. De fandt ud af, at mange af obligationerne bare flyder rundt og binder kortvarigt for at give slip igen. Men da forskerne deformerede netværkene, fandt de ud af, at mange bindinger rejser til særligt beskadigede steder for at binde. Mulla siger, at "fordi fangstbindingerne akkumuleres på svage steder, når og hvor de er nødvendige for at gøre netværket meget stærkt."
Relation til sygdomme
Undersøgelsen omfattede en mutant version af det samme protein, en som vides at forekomme med en genetisk sygdom, der fører til nyresvigt. I modsætning til en almindelig catch bond fandt forskerne ud af, at denne mutante version altid var aktiv. Denne øgede bindingsstyrke gør det svært for mutanten at bevæge sig rundt, men gør paradoksalt nok også netværkene svagere, da bindingerne ikke akkumuleres, hvor det er nødvendigt, siger gruppeleder Gijsje Koenderink:"Ved at forstå mutantproteinet bedre, vil vi i fremtiden måske også forstå processen med nyresvigt. Derudover håber vi at forstå, hvordan catch bonds spiller en rolle i, hvor invasive cancerceller er."
Materielt perspektiv på livet
Forskergruppen af professor Koenderink ved Delft University of Technology er primært interesseret i materielle egenskaber ved levende stof. Et centralt tema i hendes gruppe er, at levende celler og væv skal være dynamiske og fleksible, men også stærke:"Denne egenskab er anderledes end alle syntetiske materialer, vi kender," siger Koenderink. "Vores ambition er at lære nye designprincipper fra levende materialer for at lave syntetiske materialer, der kan være både fleksible og stærke på samme tid. Faktisk arbejder vi i øjeblikket sammen med kemikere og biofysikere som Sander Tans på AMOLF for at forsøge at lave sådanne syntetiske catch bonds." + Udforsk yderligere
Brug af lanthanid-lanthanid-bindinger til at skabe mere kraftfulde permanente magneter
 Varme artikler
Varme artikler
-
 Udvikling af film med justerbar forlængelse og brud til forskellige formålDobbelt-termisk og foto-tværbinding af polymerkæder til syntese af alsidig elastomer. Forskere fra Japan formåede at udvikle en elastomerfilm med justerbar elasticitet ved hjælp af en to-trins termisk
Udvikling af film med justerbar forlængelse og brud til forskellige formålDobbelt-termisk og foto-tværbinding af polymerkæder til syntese af alsidig elastomer. Forskere fra Japan formåede at udvikle en elastomerfilm med justerbar elasticitet ved hjælp af en to-trins termisk -
 Heavy metal torden:Protein kan tændes for at lede elektricitet som et metalLindsay udforskede interaktionerne mellem et protein, kaldet et integrin (alphaVbeta3), og dets mål, kaldet en ligand (RGDfC). Lindsays team var i stand til at fremstille en nanoenhed til mere fint at
Heavy metal torden:Protein kan tændes for at lede elektricitet som et metalLindsay udforskede interaktionerne mellem et protein, kaldet et integrin (alphaVbeta3), og dets mål, kaldet en ligand (RGDfC). Lindsays team var i stand til at fremstille en nanoenhed til mere fint at -
 Et nyt regime til analyse af egenskaber af topologiske materialerEt par nye undersøgelser viser, at to metallegeringer er i stand til at omdanne lys til elektrisk strøm effektivt takket være deres topologi. Denne grundlæggende forskning kan give en ny tilgang til u
Et nyt regime til analyse af egenskaber af topologiske materialerEt par nye undersøgelser viser, at to metallegeringer er i stand til at omdanne lys til elektrisk strøm effektivt takket være deres topologi. Denne grundlæggende forskning kan give en ny tilgang til u -
 Biologiske signalprocesser i intelligente materialerKredit:Albert-Ludwigs-Universität Freiburg Forskere fra University of Freiburg har udviklet materialesystemer, der er sammensat af biologiske komponenter og polymermaterialer og er i stand til at
Biologiske signalprocesser i intelligente materialerKredit:Albert-Ludwigs-Universität Freiburg Forskere fra University of Freiburg har udviklet materialesystemer, der er sammensat af biologiske komponenter og polymermaterialer og er i stand til at
- COVID-19:Aeolus og vejrudsigter
- Sådan finder du overfladearealet af Basic 3-D Figures
- En klogere, sikrere måde at bekæmpe korrosion:Forskning viser, at ny korrosionsinhibitor er 10 gan…
- En ny gletsjerhjemmeside fra de østrigske alper
- Dannelse af en enorm undervandsvulkan ud for Comorerne
- Flyvende taxaer inden for fem år? Ikke sandsynligt


