Kemokinreceptor CX3CR1-strukturer afslører mekanisme for kolesterolregulering ved aktivering
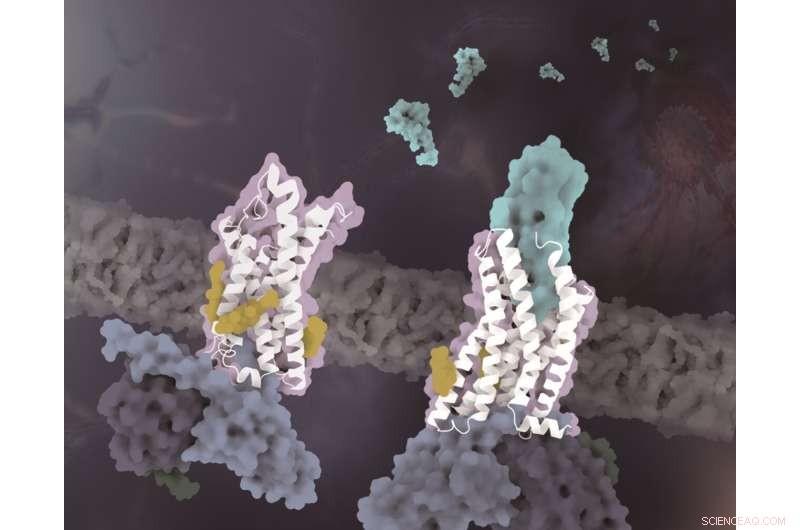
Strukturerne af CX3CR1 i distinkte konformationelle tilstande. CX3CR1 i både ligandfri tilstand og CX3CL1-bundet tilstand er farvet hvid. CX3CL1 er farvet cyan, kolesterolerne er farvet gule og de tre underenheder af G-proteinet er farvet henholdsvis lyseblå, mørkeblå og mørkegrøn. Kredit:Zhao Qiangs laboratorium på SIMM
Kemokinreceptorer regulerer migrationen af immunceller og er involveret i inflammation, tumorkonstruktion og patogeninfektion. Kemokiner er opdelt i fire underfamilier i henhold til antallet og fordelingen af konserverede cysteiner ved N-terminalen:CC, CXC, CX3C og XC.
Kemokinerne genkender deres receptorer i den samme underfamilie, hvilket komplicerer målrettet lægemiddeludvikling. Som det eneste medlem af CX3C-kemokinreceptorunderfamilien præsenterer CX3CR1 en unik fordel som et potentielt lægemiddelmål i behandlingen af åreforkalkning, cancer og neuropati. Lægemiddeludviklingen af CX3CR1 hæmmes dog delvist af manglen på strukturel information, der styrer kemokingenkendelse og receptoraktivering.
I en undersøgelse offentliggjort i Science Advances den 29. juni gjorde et forskerhold ledet af Zhao Qiang og Wu Beili fra Shanghai Institute of Materia Medica (SIMM) fra det kinesiske videnskabsakademi et gennembrud inden for kemokinreceptorer ved at løse kryo-elektronmikroskopistrukturerne i CX3CR1 -Gi- og CX3CR1-CX3CL1-Gi-komplekser.
Selvom adskillige kemokinreceptorkompleksstrukturer i CC- og CXC-underfamilierne er blevet løst, forbliver den molekylære mekanisme for den unikke genkendelse af CX3CR1 og CX3CL1 ukendt. Med analysen af strukturer og sekvensjustering fandt forskerne ud af, at de unikke strukturelle træk ved 30'er-løkken i CX3CL1 og ECL2-regionen i CX3CR1 spiller en nøglerolle i genkendelsen med formkomplementaritetsmekanisme. Sammenlignet med CC- og CXC-kemokinerne resulterer det specifikke CX3C-motiv af CX3CL1 i et større skift af 30'er-løkken mod CX3CR1 ECL2.
Da ECL2 i CX3CR1 indeholder færre rester end andre kemokinreceptorer, giver den kortere ECL2 i CX3CR1-CX3CL1 strukturen tilsvarende plads til 30'er-løkken af CX3CL1. Imidlertid udviser 30'er-løkken af andre kemokinunderfamilier uforlænget konformation, som er komplementær til overfladen af længere ECL2 af de tilsvarende receptorer.
Dette er første gang, videnskabsmænd har givet det strukturelle grundlag for at belyse den molekylære mekanisme for specifik genkendelse mellem CX3CR1 og dens unikke endogene ligand.
Ud over specificiteten af kemotaktisk signalgenkendelse afslører et andet vigtigt fund i denne undersøgelse, at kolesterolmolekyler regulerer aktiveringen af CX3CR1. I de komplekse strukturer af både CX3CL1-bundne og konstitutivt aktiverede tilstande blev tre kolesteroler observeret at stabilisere helix VI af CX3CR1 med en meget mindre konformationsændring end tidligere løst klasse A GPCR-Gi kompleks strukturer. Understøttet af funktionelle data fra CX3CR1 og andre kemokinreceptorer, verificeres kolesterolerne yderligere til at spille specifikke essentielle roller i konformationsstabilisering og signaltransduktion af CX3CR1.
Denne undersøgelse giver indsigt i den unikke kemokingenkendelsesmekanisme for den humane kemokinreceptorunderfamilie. De forskellige kolesterolbindingssteder i CX3CR1 uddyber vores viden om moduleringen af kolesteroler i GPCR'er. + Udforsk yderligere
Forskere gør gennembrud i forståelsen af serotoninreceptorer
Sidste artikelEnhed på størrelse med mønt registrerer mæslingevirus i spyt
Næste artikelJagt på giftige stoffer i slam
 Varme artikler
Varme artikler
-
 Vask genstridige biofilm væk ved hjælp af svampe rengøringsmidlerKredit:University of Tsukuba Lurer inde i rør og på overflader af medicinsk udstyr, slimede lag af bakterier, kaldet biofilm, forårsage problemer lige fra storskala produktkontaminering til potent
Vask genstridige biofilm væk ved hjælp af svampe rengøringsmidlerKredit:University of Tsukuba Lurer inde i rør og på overflader af medicinsk udstyr, slimede lag af bakterier, kaldet biofilm, forårsage problemer lige fra storskala produktkontaminering til potent -
 Stopper svovl-shuttlen for bedre batterierAt inkorporere et lag hierarkisk porøst grafen i lithium-svovl-batterier hjælper med at overvinde en af de største begrænsninger ved disse typer batterier. Kredit:2021 KAUST; Anastasia Serin Eft
Stopper svovl-shuttlen for bedre batterierAt inkorporere et lag hierarkisk porøst grafen i lithium-svovl-batterier hjælper med at overvinde en af de største begrænsninger ved disse typer batterier. Kredit:2021 KAUST; Anastasia Serin Eft -
 Undersøgelse beskriver cellulære fabrikker mere detaljeretKredit:CC0 Public Domain Mange vigtige naturlige produkter såsom antibiotika, immunsuppressiva og kræftlægemidler er afledt af mikroorganismer. Disse naturlige produkter er ofte små proteiner elle
Undersøgelse beskriver cellulære fabrikker mere detaljeretKredit:CC0 Public Domain Mange vigtige naturlige produkter såsom antibiotika, immunsuppressiva og kræftlægemidler er afledt af mikroorganismer. Disse naturlige produkter er ofte små proteiner elle -
 Porcupinefish inspirerer robust superhydrofobt materialeKredit:American Chemical Society Naturen har udviklet et blændende udvalg af materialer, der hjælper organismer med at trives i forskellige levesteder. Sommetider, videnskabsmænd kan udnytte disse
Porcupinefish inspirerer robust superhydrofobt materialeKredit:American Chemical Society Naturen har udviklet et blændende udvalg af materialer, der hjælper organismer med at trives i forskellige levesteder. Sommetider, videnskabsmænd kan udnytte disse
- Instagram-medstiftere trækker sig fra sociale medier
- XSEDE-supercomputertildelinger på Stampede1 og Comet hjælper med at prøve proteinfoldning i knogl…
- Stormflod,
- Bærbare sensorer registrerer, hvad der er i din sved
- Hvilke planeter har ingen årstider?
- Patentforedrag:Slap af, ingen ville blive forstyrret af dine stemmekommandoer i det offentlige rum


