Brug af elektrokemiske teknikker til at designe katalysatorer til bæredygtige brændstoffer
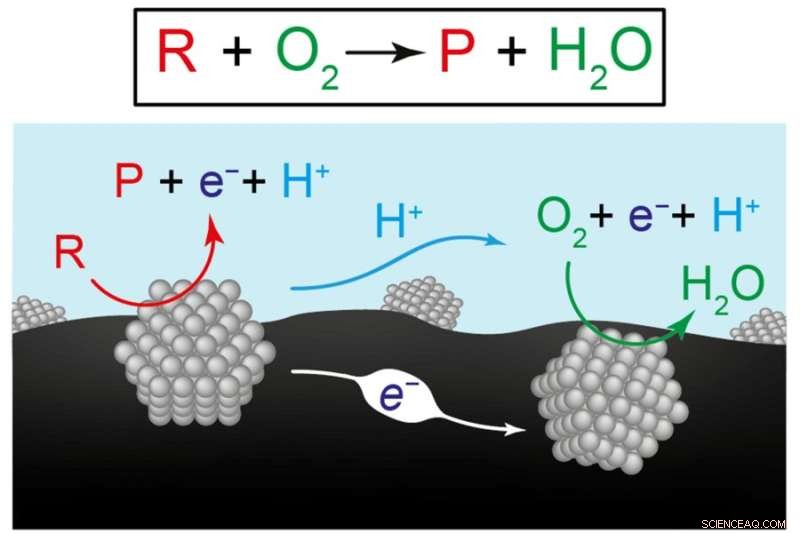
Denne figur viser to visninger af de kemiske reaktioner til fremstilling af vedvarende brændstoffer og kemikalier. Den øverste ligning repræsenterer omdannelsen af reaktanten (R) plus oxygen (O2) til et produkt (P) plus vand (H2O). Diagrammet nedenfor illustrerer forskernes hypotese om, at den samlede reaktion er resultatet af to koordinerede halvreaktioner, der forekommer på separate katalysatormaterialer, her repræsenteret af grå strukturer. På den venstre katalysator bliver reaktanten til et produkt, der sender elektroner (e-) ind i kulstofbærematerialet (sort) og protoner (H+) til vand (blå). På den højre katalysator forbruges elektroner og protoner, da de driver reaktionen mellem ilt og vand. Kredit:Billede udlånt af forskerne.
En udfordring i at dekarbonisere energisystemet er at vide, hvordan man håndterer nye typer brændstoffer. Traditionelle brændstoffer som naturgas og olie kan kombineres med andre materialer og derefter opvarmes til høje temperaturer, så de kemisk reagerer for at producere andre nyttige brændstoffer eller stoffer, eller endda energi til at udføre arbejde. Men nye materialer som biobrændstoffer kan ikke tage så meget varme uden at gå i stykker.
En nøgleingrediens i sådanne kemiske reaktioner er en specialdesignet fast katalysator, der tilsættes for at tilskynde reaktionen til at ske, men som ikke selv forbruges i processen. Med traditionelle materialer interagerer den faste katalysator typisk med en gas; men med brændstoffer afledt af biomasse, for eksempel, skal katalysatoren arbejde med en væske - en særlig udfordring for dem, der designer katalysatorer.
I næsten et årti har Yogesh Surendranath, lektor i kemi ved MIT, fokuseret på kemiske reaktioner mellem faste katalysatorer og væsker, men i en anden situation:i stedet for at bruge varme til at drive reaktioner, input han og hans team elektricitet fra en batteri eller en vedvarende kilde som vind eller sol for at give kemisk inaktive molekyler mere energi, så de reagerer. Og nøglen til deres forskning er at designe og fremstille faste katalysatorer, der fungerer godt til reaktioner, der involverer væsker.
I erkendelse af behovet for at bruge biomasse til at udvikle bæredygtige flydende brændstoffer, spekulerede Surendranath på, om han og hans team kunne tage de principper, de har lært om at designe katalysatorer til at drive væske-faste reaktioner med elektricitet og anvende dem på reaktioner, der forekommer ved væske-faste grænseflader uden enhver tilførsel af elektricitet.
Til deres overraskelse fandt de ud af, at deres viden er direkte relevant. Hvorfor? "Hvad vi fandt - utroligt nok - er, at selv når du ikke tilslutter ledninger til din katalysator, er der små interne 'ledninger', der udfører reaktionen," siger Surendranath. "Så reaktioner, som folk generelt tror, fungerer uden nogen strøm af strøm involverer faktisk elektroner, der pendler fra et sted til et andet." Og det betyder, at Surendranath og hans team kan bringe elektrokemiens kraftfulde teknikker til anvendelse på problemet med at designe katalysatorer til bæredygtige brændstoffer.
En ny hypotese
Deres arbejde har fokuseret på en klasse af kemiske reaktioner, der er vigtige i energiovergangen, der involverer tilsætning af ilt til små organiske (kulstofholdige) molekyler såsom ethanol, methanol og myresyre. Den konventionelle antagelse er, at reaktanten og oxygenet kemisk reagerer for at danne produktet plus vand. Og en fast katalysator - ofte en kombination af metaller - er til stede for at give steder, hvor reaktanten og oxygen kan interagere.
Men Surendranath foreslog et andet syn på, hvad der foregår. I den sædvanlige opsætning er to katalysatorer, hver sammensat af mange nanopartikler, monteret på et ledende kulstofsubstrat og nedsænket i vand. I det arrangement kan negativt ladede elektroner let strømme gennem kulstoffet, mens positivt ladede protoner let kan strømme gennem vand.
Surendranaths hypotese var, at omdannelsen af reaktant til produkt skrider frem ved hjælp af to separate "halvreaktioner" på de to katalysatorer. På en katalysator bliver reaktanten til et produkt, hvorved elektroner sendes ind i kulstofsubstratet og protoner i vandet. Disse elektroner og protoner opfanges af den anden katalysator, hvor de driver ilt-til-vand-omdannelsen. Så i stedet for en enkelt reaktion opnår to separate, men koordinerede halvreaktioner sammen nettoomdannelsen af reaktant til produkt.
Som et resultat involverer den samlede reaktion faktisk ikke nogen nettoelektronproduktion eller -forbrug. Det er en standard "termisk" reaktion som følge af energien i molekylerne og måske noget tilført varme. Den konventionelle tilgang til at designe en katalysator til en sådan reaktion ville fokusere på at øge hastigheden af den reaktant-til-produkt-omdannelse. Og den bedste katalysator for den slags reaktioner kunne vise sig at være guld eller palladium eller et andet dyrt ædelmetal.
Men hvis den reaktion faktisk involverer to halvreaktioner, som Surendranath foreslog, er der en strøm af elektrisk ladning (elektronerne og protonerne) mellem dem. Så Surendranath og andre i feltet kunne i stedet bruge teknikker inden for elektrokemi til at designe ikke en enkelt katalysator til den samlede reaktion, men snarere to separate katalysatorer - en til at fremskynde den ene halvreaktion og en til at fremskynde den anden halvreaktion. "Det betyder, at vi ikke behøver at designe én katalysator for at gøre alt det tunge løft ved at fremskynde hele reaktionen," siger Surendranath. "Vi vil måske være i stand til at parre to billige, jordrige katalysatorer, som hver især klarer halvdelen af reaktionen godt, og sammen udfører de den overordnede transformation hurtigt og effektivt."
Men der er en overvejelse mere:Elektroner kan strømme gennem hele katalysatorkompositten, som omfatter katalysatorpartiklerne og kulstofsubstratet. For at den kemiske omdannelse kan ske så hurtigt som muligt, skal den hastighed, hvormed elektroner sættes ind i katalysatorkompositten, nøjagtigt svare til den hastighed, hvormed de tages ud. Med fokus på kun elektronerne, hvis reaktion-til-produkt-omdannelsen på den første katalysator sender det samme antal elektroner pr. sekund ind i "elektronbadet" i katalysatorkompositten, som oxygen-til-vand-omdannelsen på den anden katalysator tager ud, vil de to halvreaktioner være afbalancerede, og elektronstrømmen - og hastigheden af den kombinerede reaktion - vil være hurtig. Tricket er at finde gode katalysatorer for hver af halvreaktionerne, der er perfekt afstemt med hensyn til elektroner ind og elektroner ud.
"En god katalysator eller et par katalysatorer kan opretholde et elektrisk potentiale - i det væsentlige en spænding - hvor begge halvreaktioner er hurtige og afbalancerede," siger Jaeyune Ryu Ph.D. '21, et tidligere medlem af Surendranath-laboratoriet og hovedforfatter af undersøgelsen; Ryu er nu postdoc ved Harvard University. "Hastighederne af reaktionerne er ens, og spændingen i katalysatorkompositten vil ikke ændre sig under den overordnede termiske reaktion."
Tegner på elektrokemi
Baseret på deres nye forståelse vendte Surendranath, Ryu og deres kolleger sig til elektrokemiske teknikker for at identificere en god katalysator for hver halvreaktion, som også ville fungere godt sammen. Deres analytiske ramme til vejledning af katalysatorudvikling for systemer, der kombinerer to halvreaktioner, er baseret på en teori, der har været brugt til at forstå korrosion i næsten 100 år, men som sjældent er blevet anvendt til at forstå eller designe katalysatorer til reaktioner, der involverer små molekyler, der er vigtige for energiomstilling.
Key to their work is a potentiostat, a type of voltmeter that can either passively measure the voltage of a system or actively change the voltage to cause a reaction to occur. In their experiments, Surendranath and his team use the potentiostat to measure the voltage of the catalyst in real time, monitoring how it changes millisecond to millisecond. They then correlate those voltage measurements with simultaneous but separate measurements of the overall rate of catalysis to understand the reaction pathway.
For their study of the conversion of small, energy-related molecules, they first tested a series of catalysts to find good ones for each half-reaction—one to convert the reactant to product, producing electrons and protons, and another to convert the oxygen to water, consuming electrons and protons. In each case, a promising candidate would yield a rapid reaction—that is, a fast flow of electrons and protons out or in.
To help identify an effective catalyst for performing the first half-reaction, the researchers used their potentiostat to input carefully controlled voltages and measured the resulting current that flowed through the catalyst. A good catalyst will generate lots of current for little applied voltage; a poor catalyst will require high applied voltage to get the same amount of current. The team then followed the same procedure to identify a good catalyst for the second half-reaction.
To expedite the overall reaction, the researchers needed to find two catalysts that matched well—where the amount of current at a given applied voltage was high for each of them, ensuring that as one produced a rapid flow of electrons and protons, the other one consumed them at the same rate.
To test promising pairs, the researchers used the potentiostat to measure the voltage of the catalyst composite during net catalysis—not changing the voltage as before, but now just measuring it from tiny samples. In each test, the voltage will naturally settle at a certain level, and the goal is for that to happen when the rate of both reactions is high.
Validating their hypothesis and looking ahead
By testing the two half-reactions, the researchers could measure how the reaction rate for each one varied with changes in the applied voltage. From those measurements, they could predict the voltage at which the full reaction would proceed fastest. Measurements of the full reaction matched their predictions, supporting their hypothesis.
The team's novel approach of using electrochemistry techniques to examine reactions thought to be strictly thermal in nature provides new insights into the detailed steps by which those reactions occur and therefore into how to design catalysts to speed them up. "We can now use a divide-and-conquer strategy," says Ryu. "We know that the net thermal reaction in our study happens through two 'hidden' but coupled half-reactions, so we can aim to optimize one half-reaction at a time"—possibly using low-cost catalyst materials for one or both.
Adds Surendranath, "One of the things that we're excited about in this study is that the result is not final in and of itself. It has really seeded a brand-new thrust area in our research program, including new ways to design catalysts for the production and transformation of renewable fuels and chemicals." + Udforsk yderligere
Cheap, eco-friendly catalyst opens new possibilities for organic molecules built from pyruvate
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT-forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 Hvilken konverteringsfaktor findes i næsten alle beregninger af støkiometri?Konverteringsfaktoren gram pr. mol i støkiometri er næsten altid til stede, og det giver kemikere mulighed for at forudsige, hvilke vægters materialer der er nødvendige for en kemisk reaktion. For
Hvilken konverteringsfaktor findes i næsten alle beregninger af støkiometri?Konverteringsfaktoren gram pr. mol i støkiometri er næsten altid til stede, og det giver kemikere mulighed for at forudsige, hvilke vægters materialer der er nødvendige for en kemisk reaktion. For -
 Fladere materialer har færre ufuldkommenheder, hvilket giver bedre solceller og lyssensorerForbedring af effektiviteten af materialer vil bidrage til yderligere fremskridt inden for design og optimering af perovskit-solceller. Kredit:KAUST Forbedring af solcellernes effektivitet kræve
Fladere materialer har færre ufuldkommenheder, hvilket giver bedre solceller og lyssensorerForbedring af effektiviteten af materialer vil bidrage til yderligere fremskridt inden for design og optimering af perovskit-solceller. Kredit:KAUST Forbedring af solcellernes effektivitet kræve -
 Stort overfladeareal giver superkræfter til ultraporøse materialerMetalorganiske rammer set under et elektronmikroskop er opbygget af krystaller, der tilsammen former flerdimensionelle strukturer med store overfladearealer. Kredit:CSIRO/ Dr. Paolo Falcaro, Dr. Dario
Stort overfladeareal giver superkræfter til ultraporøse materialerMetalorganiske rammer set under et elektronmikroskop er opbygget af krystaller, der tilsammen former flerdimensionelle strukturer med store overfladearealer. Kredit:CSIRO/ Dr. Paolo Falcaro, Dr. Dario -
 Laserbehandling viser potentiale for at reducere industriel kemisk behandling af køretøjerORNL-forsker Adrian Sabau beskriver komponenter i et laserinterferensstruktureringssystem, der blev brugt til at behandle aluminiumslegeringsplader til korrosionsbeskyttelse. Kredit:Carlos Jones/ORNL,
Laserbehandling viser potentiale for at reducere industriel kemisk behandling af køretøjerORNL-forsker Adrian Sabau beskriver komponenter i et laserinterferensstruktureringssystem, der blev brugt til at behandle aluminiumslegeringsplader til korrosionsbeskyttelse. Kredit:Carlos Jones/ORNL,
- Overgrebene steg på Trump-mødedage under valget i 2016
- Coatede zinksulfidnanopartikler er katalytisk aktive
- Aktiv læring fremskynder redox-flow batteri opdagelse
- Lungerne kan lide, når visse elementer bliver nano
- Undersøgelse magnetiserer kulstofnanopartikler til kræftbehandling
- Katalytisk aktivitet af individuelle cobaltoxidnanopartikler bestemt


