Nyt simuleringsværktøj fremmer molekylær modellering af biomolekylære kondensater
Et team fra University of Massachusetts Amherst har gjort et stort fremskridt i retning af modellering og forståelse af, hvordan iboende forstyrrede proteiner (IDP'er) gennemgår spontan faseadskillelse, en vigtig mekanisme for subcellulær organisering, der ligger til grund for adskillige biologiske funktioner og menneskelige sygdomme.
IDP'er spiller afgørende roller i kræft, neurodegenerative lidelser og infektionssygdomme. De udgør omkring en tredjedel af proteiner, som menneskekroppe producerer, og to tredjedele af kræftassocierede proteiner indeholder store, uordnede segmenter eller domæner. At identificere de skjulte funktioner, der er afgørende for IDP'ers funktion og selvsamling, vil hjælpe forskerne med at forstå, hvad der går galt med disse funktioner, når sygdomme opstår.
I et papir offentliggjort i Journal of the American Chemical Society , beskriver seniorforfatter Jianhan Chen, professor i kemi, en ny måde at simulere faseadskillelser medieret af IDP'er, en vigtig proces, som har været svær at studere og beskrive.
"Faseadskillelse er et virkelig velkendt fænomen i polymerfysik, men hvad folk ikke vidste før for omkring 15 år siden, var, at dette også er et meget almindeligt fænomen i biologi," forklarer Chen. "Man kan se på faseadskillelse med et mikroskop, men det er meget svært at forstå dette fænomen på molekylært niveau.
"I de sidste fem eller ti år er folk begyndt at opdage, at mange af disse forstyrrede proteiner kan drive faseadskillelse, herunder adskillige vigtige, involveret i kræft og neurodegenerative lidelser."
Det nye papir, der er baseret på forskning i Chens beregningsbaserede biofysik- og biomaterialelaboratorium, udgør et kapitel af hovedforfatteren Yumeng Zhangs Ph.D. afhandling. Zhang begynder at arbejde som postdoc-forsker ved Massachusetts Institute of Technology (MIT) i februar. En anden vigtig bidragyder er Shanlong Li, en postdoktoral forskningsmedarbejder i Chens laboratorium.
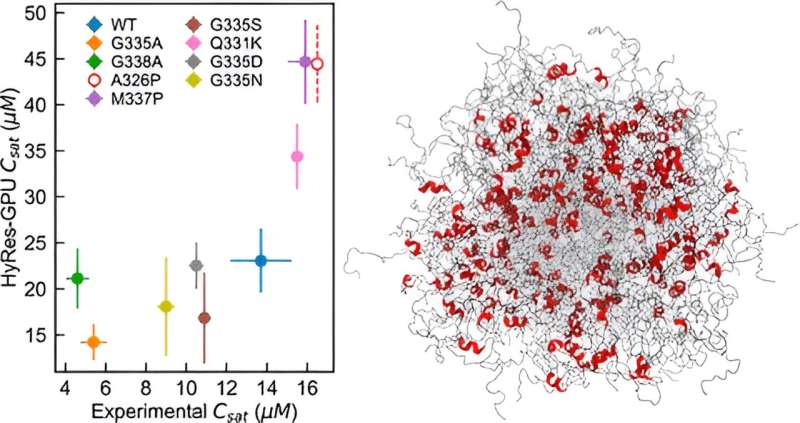
Chens laboratorium udviklede et nøjagtigt, GPU-accelereret hybrid opløsning (HyRes) kraftfelt til simulering af faseadskillelser medieret af IDP'er. Denne model er unik i sin evne til nøjagtigt at beskrive peptidrygradsinteraktioner og forbigående sekundære strukturer, samtidig med at den er beregningsmæssig effektiv nok til at modellere væske-væskefaseseparation. Denne nye model udfylder et kritisk hul i den eksisterende kapacitet inden for computersimulering af IDP-faseseparation.
Chen og teamet skabte HyRes-simuleringer for for første gang at demonstrere, hvad der styrer kondensatstabiliteten af to vigtige IDP'er.
"Jeg havde faktisk ikke forudset, at det kunne gøre et så godt stykke arbejde med at beskrive faseadskillelse, fordi det er et virkelig svært fænomen at simulere," siger Chen. "Vi demonstrerede, at denne model er nøjagtig nok til at begynde at se på virkningerne af selv en enkelt mutation eller resterende strukturer i faseadskillelsen."
Forskernes HyRes-GPU giver et innovativt simuleringsværktøj til at studere de molekylære mekanismer for faseadskillelse. Det ultimative mål er at udvikle terapeutiske strategier til behandling af sygdomme forbundet med forstyrrede proteiner.
"Dette er virkelig betydningen af dette arbejde," siger Chen. "Vigtige biologiske processer menes at forekomme gennem faseadskillelse. Så hvis vi bedre kan forstå, hvad der styrer denne proces, vil den viden være virkelig kraftfuld, hvis ikke essentiel, for os at tænke på at kontrollere faseadskillelse til forskellige videnskabelige og tekniske formål. Dette vil hjælpe os med at forstå den type intervention, der vil være påkrævet for at opnå terapeutiske effekter."
Chen siger, at det næste skridt er at anvende det, hans team har lært, til simuleringer i større skala af mere komplekse biomolekylære blandinger.
"Shanlong arbejder nu på at konstruere en lignende model for nukleinsyrer, fordi faseseparation ofte involverer både forstyrrede proteiner og nukleinsyrer," siger han. "Vi ønsker at kunne beskrive begge nøglekomponenter, og det ville give os mulighed for at se på mange flere systemer."
Flere oplysninger: Yumeng Zhang et al., Toward Accurate Simulation of Coupling between Protein Secondary Structure and Phase Separation, Journal of the American Chemical Society (2023). DOI:10.1021/jacs.3c09195
Journaloplysninger: Tidsskrift for American Chemical Society
Leveret af University of Massachusetts Amherst
 Varme artikler
Varme artikler
-
 CRISPR-metode til betinget genreguleringWilfred Chen (til venstre), University of Delaware Gore professor i kemiteknik, og kandidatstuderende Ka-Hei Siu designede strukturer til målrettet genregulering i E. coli-bakterier. Kredit:University
CRISPR-metode til betinget genreguleringWilfred Chen (til venstre), University of Delaware Gore professor i kemiteknik, og kandidatstuderende Ka-Hei Siu designede strukturer til målrettet genregulering i E. coli-bakterier. Kredit:University -
 ARS bomuldsforskud hjælper med at starte sårforbindingTACgauze er en ny ikke -vævet bomuldsgas fra ARS og samarbejdspartnere, der hjælper med at standse blødninger og fremme sårheling. Kredit:H&H En ny, ikke -vævet bomuldsbind, der hurtigt standser b
ARS bomuldsforskud hjælper med at starte sårforbindingTACgauze er en ny ikke -vævet bomuldsgas fra ARS og samarbejdspartnere, der hjælper med at standse blødninger og fremme sårheling. Kredit:H&H En ny, ikke -vævet bomuldsbind, der hurtigt standser b -
 Hydrogeneringsregulering af nitrobenzen i elektrokatalytiske processer realiseretGrafisk abstrakt. En omfattende forståelse af selektiviteten over for elektrokatalytiske hydrogeneringsprodukter af nitrobenzen blev udført eksperimentelt og teoretisk over en Cu3Pt/C -legeringskataly
Hydrogeneringsregulering af nitrobenzen i elektrokatalytiske processer realiseretGrafisk abstrakt. En omfattende forståelse af selektiviteten over for elektrokatalytiske hydrogeneringsprodukter af nitrobenzen blev udført eksperimentelt og teoretisk over en Cu3Pt/C -legeringskataly -
 DIY-pumpe tager videnskaben ud af laboratorietForskere har udviklet en billig og enkel pumpe, lavet af balloner og strømper, som kan bruges til at analysere vand- og blodprøver uden for laboratoriet. Kredit:Walter og Eliza Hall Institute of Medic
DIY-pumpe tager videnskaben ud af laboratorietForskere har udviklet en billig og enkel pumpe, lavet af balloner og strømper, som kan bruges til at analysere vand- og blodprøver uden for laboratoriet. Kredit:Walter og Eliza Hall Institute of Medic
- Aflytning af enkelte molekyler med lys ved at afspille snakken igen
- Forskere studerer det historiske Mississippi -flow og virkningerne af flodregulering
- Nogle byer i Californien tror, at de er sikre mod havstigning. De er ikke, viser ny forskning
- Ny type lysinteraktion med atomer giver mulighed for at manipulere skyform
- Rolls-Royce sælger kommerciel marineenhed
- NASA omdøber Washington HQ til Hidden Figures banebrydende


