Smelter is hurtigere i vand eller soda?
Is smelter hurtigere i vand end i sodavand. Dette skyldes, at soda har natrium (salt) i sig, og tilsætning af natrium får isen til at smelte langsommere, end det vil være i almindeligt vand. For at isen skal smelte, skal de kemiske bindinger, der forbinder vandmolekyler, brydes, og brudbindinger kræver altid energi. At tilføje natrium til en opløsning betyder, at det kræver mere energi at bryde bindinger, end det tager i almindeligt vand, hvilket bremser smeltningen.
Hydrogen Bonds
Vand er et kritisk stof for livet, som vi kender det, og i del af dens unikke egenskaber kan tilskrives den slags kemiske binding, der dannes mellem atomer i vandmolekyler og mellem selve vandmolekylerne. Oxygen og brintatomer i vandmolekyler forbindes med brintbindinger, som er svage bindinger, der konstant bryder og dannes, når molekylerne bevæger sig.
Betydning
Vandmolekyler har en masse mobilitet på grund af de svage brintbindinger, der slutter sig til dem. Derfor er vand flydende ved temperaturer over 32 grader F (og under 212 grader F, hvor det bliver damp). Jo varmere temperaturen er, jo hurtigere bevæger atomerne i molekylerne sig. Efterhånden som temperaturen falder til 32 grader F, bevæger atomerne sig langsommere, indtil de til sidst "fryser" og krystalliseres, når vandet bliver til is.
Smeltepunkt
Smeltepunktet er det punkt, hvor isen ændrer fase fra et fast stof til en væske. Smeltepunktet for almindeligt vand er 32 grader F, men natrium i soda betyder, at det skal være markant koldere end 32 grader F, før isen smelter i soda. Dette skyldes, at natrium sænker smeltepunktet for is, hvilket betyder, at opløsningen skal være koldere, før isen smelter.
Sodium's Effect
Natrium i soda sænker smeltepunktet og får isen til at smelte langsommere end det ville ske i almindeligt vand, fordi der med tilsætning af salt (eller et hvilket som helst stof) der er færre fritvandsmolekyler til rådighed til at danne bindinger sammen og "fryse" til is, når temperaturen falder. Varme skal fjernes fra opløsningen for at bryde bindinger og smelte is, hvilket sænker temperaturen på hele opløsningen og smeltepunktet for is i soda.
Overvejelser
Folk, der lever i koldt klima kan finde ud af det faktum at salt sænker smeltepunktet for is modintuitivt, da saltede veje er normen i snedækkede områder. Men under snedækkede forhold holder salt veje fri for is. Som diskuteret her sænker tilsætningen af salt temperaturen, ved hvilken vand fryser. I nærvær af saltsmeltende sne forbliver sne flydende ved lave temperaturer i stedet for at dreje til is og gøre veje glatte.
Sidste artikelHvorfor brænder is og salt sammen huden?
Næste artikelHvorfor har is en lavere varmekapacitet end flydende vand?
 Varme artikler
Varme artikler
-
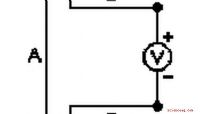 Hvad anvendes termoelementer til?Termoelementer er temperatursensorer, der er lavet af to metallegeringer. Når de to metaller er samlet sammen for at danne et kryds, genereres en spænding, når der er temperaturforskelle mellem dem. D
Hvad anvendes termoelementer til?Termoelementer er temperatursensorer, der er lavet af to metallegeringer. Når de to metaller er samlet sammen for at danne et kryds, genereres en spænding, når der er temperaturforskelle mellem dem. D -
 Sådan beregnes ladning af en ionAtomer er generelt neutrale, fordi de har det samme antal protoner (positivt ladede partikler) som elektroner eller negativt ladede partikler. Imidlertid er mange atomer ustabile, så de danner ione
Sådan beregnes ladning af en ionAtomer er generelt neutrale, fordi de har det samme antal protoner (positivt ladede partikler) som elektroner eller negativt ladede partikler. Imidlertid er mange atomer ustabile, så de danner ione -
 Sådan testes Glass HardnessMaterialets hårdhed forstås almindeligvis som modstand mod ridser eller slid. Imidlertid anvendes forskellige test til at måle forskellige aspekter af materialets hårdhed i overensstemmelse med de mek
Sådan testes Glass HardnessMaterialets hårdhed forstås almindeligvis som modstand mod ridser eller slid. Imidlertid anvendes forskellige test til at måle forskellige aspekter af materialets hårdhed i overensstemmelse med de mek -
 Dræber hydrogenperoxid bakterier?Hydrogenperoxid er vidt brugt til at behandle nedskæringer og skrammer, men nogle kilder advarer om, at det ikke pålideligt dræber alle bakterier og endda kan skade helende væv. Brintperoxidmolekyl
Dræber hydrogenperoxid bakterier?Hydrogenperoxid er vidt brugt til at behandle nedskæringer og skrammer, men nogle kilder advarer om, at det ikke pålideligt dræber alle bakterier og endda kan skade helende væv. Brintperoxidmolekyl


