Svovlsyre & klorreaktion
Klorblekemiddel er en opløsning af natriumhypochlorit og vand. Klorgas produceres, når svovlsyre blandes med klorblekemiddel. Denne reaktion er en funktion af ændringen i pH i opløsningen fra alkalisk til sur kombineret med de stærke oxidationsegenskaber af hypochlorsyre.
Syrer og baser
En syre er en kemisk forbindelse, der donerer en hydrogenion Forbindelsen, der modtager hydrogenionen, kaldes en base. Den normale pH-måling for rent vand er 7,0. Når en sur forbindelse opløses i vand, har den resulterende opløsning en pH-værdi under 7,0. Når en base, eller en alkalisk forbindelse er opløst i vand, er pH-værdien i opløsningen højere end 7,0.
Oxiderende stoffer
Et oxidationsmiddel er et kemikalie med en stærk affinitet for elektroner. I en oxidationsreduktionsreaktion (eller redox-kemisk reaktion) modtager oxidationsmidlet elektroner, mens reduktionsmidlet mister elektroner.
Chlorine Beach
Sodium hypochlorite (NaClO) er en stabiliseret form af klor. Klorblegemiddel, der anvendes i hjemmet, er normalt 3% til 6% natriumhypochlorit blandet med vand. Tilsætning af natriumhypochlorit til vand skaber hypochlorsyre (HOCl) og natriumhydroxid (NaOH). Formlen for denne reaktion kan udtrykkes som følger: NaOCl + H2O? HOCl + NaOH-. Natriumhydroxid er en base, der gør husholdningsblekemid alkalisk med en pH på ca. 12,5.
Svovlsyre
Svovlsyre (H2SO4) er en farveløs, lugtfri og tyktflydende væske. Svovlsyre er en ekstremt ætsende oxidationsmiddel. Når den fortyndes i en vandopløsning, dissoceres svovlsyre til en kation med hydrogen (H +) og sulfat (SO4-2). Svovlsyre i vand skaber en stærkt sur opløsning med en pH-værdi, der varierer i forhold til andelen svovlsyre til vand.
Blegemiddel og svovlsyre
Når en syre blandes med natriumhypochlorit, vil syren donere et brintmolekyle til forbindelsen, der erstatter natriummolekylet (Na) til frembringelse af hypochlorsyre (HClO). Blanding af svovlsyre med en opløsning af natriumhypochlorit vil resultere i en opløsning af natriumsulfat (Na2SO4) og hypochlorsyre.
Ved hjælp af subscriptet (aq) til at repræsentere forbindelserne i opløsning kan formlen udtrykkes som følger : 2NaOCl (aq) + H2SO4 (aq) \u003d> Na2SO4 (aq) + 2HClO (aq).
Blegemiddel og klorgas
Reaktionen af svovlsyre og natriumhypochlorit stopper ikke med produktionen af natriumsulfat og hypochlorsyre. I vandopløsninger når hypocholorit (HClO) og klor (Cl2) en ligevægt, der er afhængig af opløsningens pH. I en sur opløsning favoriserer ligevægten chlor på følgende måde: Hypochlorsyre nedbrydes delvist i hypochlorit-anionen (OCl?) Og hydrogenkation (H +). Hypochlorsyre er en stærk oxidant, så den resterende hypochlorsyre i opløsningen oxiderer hypochloritanionen, der producerer den irriterende og giftige klorgas (Cl2).
Sidste artikelEr svedendotermisk eller eksotermisk?
Næste artikelHvorfor smelter sukker is?
 Varme artikler
Varme artikler
-
 Forskelle mellem zinkmonomethionin og zinkpicolinatBåde zinkmonomethionin og zinkpicolinat er bio-tilgængelige former for mineralzink, hvilket betyder, at de kan absorberes af tarmene og anvendes af kroppens celler. Begge former er chelaterede, hvilke
Forskelle mellem zinkmonomethionin og zinkpicolinatBåde zinkmonomethionin og zinkpicolinat er bio-tilgængelige former for mineralzink, hvilket betyder, at de kan absorberes af tarmene og anvendes af kroppens celler. Begge former er chelaterede, hvilke -
 Sådan løses oxidationstilstanden CH4Konceptet med oxidation i kemi er noget forvirrende, mest fordi det foregår en forståelse af atomets struktur og hvordan kemiske reaktioner opstår. Udtrykket stammer fra, når kemikere analyserede reak
Sådan løses oxidationstilstanden CH4Konceptet med oxidation i kemi er noget forvirrende, mest fordi det foregår en forståelse af atomets struktur og hvordan kemiske reaktioner opstår. Udtrykket stammer fra, når kemikere analyserede reak -
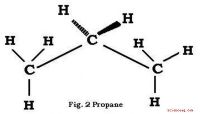 Kemisk formel til propanPropan er en gas afledt af fossilt brændsel og anvendes til madlavning og opvarmning. Analysen viser, at den er lavet helt af kulstof og hydrogen; dens basiske formel er C3H8. Formula Refinement C
Kemisk formel til propanPropan er en gas afledt af fossilt brændsel og anvendes til madlavning og opvarmning. Analysen viser, at den er lavet helt af kulstof og hydrogen; dens basiske formel er C3H8. Formula Refinement C -
 Isopropanol Alkohol Vs. IsopropylalkoholIsopropylalkohol - også kendt som isopropanol - er almindeligt kendt som gnidning af alkohol. Typisk blandes isopropylalkohol solgt til forbrugerbrug med vand og sælges som en antiseptisk eller ren
Isopropanol Alkohol Vs. IsopropylalkoholIsopropylalkohol - også kendt som isopropanol - er almindeligt kendt som gnidning af alkohol. Typisk blandes isopropylalkohol solgt til forbrugerbrug med vand og sælges som en antiseptisk eller ren


