Hvordan dannes nye stoffer
* Kombinationsreaktioner , hvor to eller flere stoffer kombineres for at danne et enkelt produkt. For eksempel, når brint og iltgasser reagerer, danner de vanddamp.
* Dekomponeringsreaktioner , hvor et enkelt stof nedbrydes til to eller flere produkter. For eksempel, når vanddamp opvarmes, nedbrydes den til brint og iltgasser.
* Enkelt-erstatningsreaktioner , hvor et grundstof erstatter et andet grundstof i en forbindelse. For eksempel, når jernmetal anbringes i en opløsning af kobbersulfat, erstatter jernet kobberet i forbindelsen og danner jernsulfat og kobbermetal.
* Dobbelt-erstatningsreaktioner , hvor to forbindelser udveksler ioner for at danne to nye forbindelser. For eksempel, når natriumchlorid (NaCl) og sølvnitrat (AgNO3) blandes, reagerer de og danner natriumnitrat (NaNO3) og sølvchlorid (AgCl).
Kemiske reaktioner kan opstå spontant, eller de kan være drevet af en ekstern energikilde, såsom varme eller lys. Den hastighed, hvormed en kemisk reaktion sker, afhænger af en række faktorer, herunder temperaturen, koncentrationen af reaktanterne og tilstedeværelsen af en katalysator.
Katalyse er processen med at øge hastigheden af en kemisk reaktion uden at blive forbrugt i reaktionen. Katalysatorer er stoffer, der deltager i en kemisk reaktion, men som ikke ændres permanent af reaktionen. Enzymer er biologiske katalysatorer, der produceres af levende organismer.
Kemiske reaktioner er afgørende for livet. De er ansvarlige for dannelsen af nye stoffer, nedbrydningen af gamle stoffer og frigivelsen af energi. Kemiske reaktioner spiller også en rolle i mange naturfænomener, såsom dannelsen af skyer, vulkanudbrud og fordøjelsen af mad.
 Varme artikler
Varme artikler
-
 Omdannelse af kuldioxidKredit:CC0 Public Domain Et team af forskere ved University of Delawares Center for Catalytic Science and Technology (CCST) har opdaget en ny to-trins proces til at øge effektiviteten af kuldiox
Omdannelse af kuldioxidKredit:CC0 Public Domain Et team af forskere ved University of Delawares Center for Catalytic Science and Technology (CCST) har opdaget en ny to-trins proces til at øge effektiviteten af kuldiox -
 Multimodal billeddannelse viser, at stamme kan drive kemi i et fotovoltaisk materialeI en tynd film af et solenergimateriale, molekyler i tvillingedomæner (modelleret i venstre og højre panel) justeres i modsatrettede orienteringer inden for korngrænser (vist ved scanning elektronmikr
Multimodal billeddannelse viser, at stamme kan drive kemi i et fotovoltaisk materialeI en tynd film af et solenergimateriale, molekyler i tvillingedomæner (modelleret i venstre og højre panel) justeres i modsatrettede orienteringer inden for korngrænser (vist ved scanning elektronmikr -
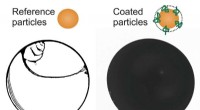 Modificering af overflader med polymerkæder fremmer ensartet tørring af partikelholdige væskerEn væske, der indeholder partikler, viser det karakteristiske tørremønster for en kaffering (til venstre). Hvis overfladen af partiklerne modificeres med overfladeaktive polymerer, tørrer dispersion
Modificering af overflader med polymerkæder fremmer ensartet tørring af partikelholdige væskerEn væske, der indeholder partikler, viser det karakteristiske tørremønster for en kaffering (til venstre). Hvis overfladen af partiklerne modificeres med overfladeaktive polymerer, tørrer dispersion -
 At skabe unikke konstruktioner fra metalmembranerCykelbanen Krylatskoye - sportsanlæg i Moskva, i Krylatskoye-distriktet. Kredit:Sergey Krivoshapko RUDN University Professor Sergey Krivoshapko har assimileret information om metalmembran-ophængte
At skabe unikke konstruktioner fra metalmembranerCykelbanen Krylatskoye - sportsanlæg i Moskva, i Krylatskoye-distriktet. Kredit:Sergey Krivoshapko RUDN University Professor Sergey Krivoshapko har assimileret information om metalmembran-ophængte
- Molekylær orientering er nøglen:Nyt lys skinner på elektronadfærd ved hjælp af 2-foton fotoemis…
- Sådan konverteres masse til densitet
- Stjernedannende filamenter
- At tale med neuroner:Nye nanostrukturerede neurale elektroder
- Samsung lancerer en foldbar smartphone i september
- Pesticider og industrielle forurenende stoffer findes i sne oven på de arktiske gletschere


