i redoxreaktionen AgNO3 + Na --> NaNO3 Ag, hvor mange elektroner blev overført?
2AgNO3 + 2Na → 2NaN03 + 2Ag
I denne reaktion mister natrium elektroner (oxidation), mens sølv får elektroner (reduktion).
Her er en mere detaljeret forklaring af processen:
1. Oxidation af natrium (Na):
- Natrium (Na) atomer mister en valenselektron hver og danner natriumioner (Na+).
- Hvert natriumatom undergår oxidation, hvilket resulterer i en stigning i dets oxidationstilstand fra 0 (i elementært natrium) til +1 (i natriumioner).
- Oxidationshalvreaktionen kan repræsenteres som:
2Na → 2Na+ + 2e-
2. Reduktion af sølv (Ag):
- Sølvioner (Ag+) får elektroner fra natriumatomerne.
- Hver sølvion accepterer en elektron, hvilket resulterer i et fald i dens oxidationstilstand fra +1 (i sølvioner) til 0 (i elementært sølv).
- Reduktionshalvreaktionen kan repræsenteres som:
2Ag+ + 2e- → 2Ag
Ved at kombinere de to halvreaktioner får vi den samlede redoxreaktion:
2AgNO3 + 2Na → 2NaN03 + 2Ag
Sammenfattende gennemgår natrium (Na) oxidation, taber elektroner og øger dets oxidationstilstand, mens sølv (Ag) gennemgår reduktion, får elektroner og sænker dets oxidationstilstand.
Sidste artikelHvilken slags forbindelse er mikroovn?
Næste artikelEr en kemisk ændring af pizza papir og en jernsøm eller fysisk ændring?
 Varme artikler
Varme artikler
-
 Undersøgelse af, hvordan tilføjelse af UV-behandling til vandklorering faktisk kan øge giftig tri…Kredit:He Zhao, Ching-Hua Huang, Chen Zhong, Penghui Du, Peizhe Sun Halobenzoquinoner (HBQer), som nye nye desinfektionsbiprodukter (DBPer), påvises ofte i drikkevand og svømmebassiner. Faktisk er
Undersøgelse af, hvordan tilføjelse af UV-behandling til vandklorering faktisk kan øge giftig tri…Kredit:He Zhao, Ching-Hua Huang, Chen Zhong, Penghui Du, Peizhe Sun Halobenzoquinoner (HBQer), som nye nye desinfektionsbiprodukter (DBPer), påvises ofte i drikkevand og svømmebassiner. Faktisk er -
 Et batteri med et twistPrototype af det fleksible batteri. (Foto:ETH Zürich / Peter Rüegg) Markus Niederbergers team af forskere ved ETH har brugt strækbare materialer til at udvikle et batteri, der kan bøjes, strakt og
Et batteri med et twistPrototype af det fleksible batteri. (Foto:ETH Zürich / Peter Rüegg) Markus Niederbergers team af forskere ved ETH har brugt strækbare materialer til at udvikle et batteri, der kan bøjes, strakt og -
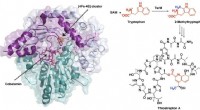 Syntese af potent antibiotikum følger en usædvanlig kemisk vejSyntesen af det potente antibiotikum thiostrepton bruger et radikalt SAM-protein TsrM, hvis krystalstruktur er vist til venstre, mens den er bundet til en jern-svovl-klynge og cobalamin. Nye billede
Syntese af potent antibiotikum følger en usædvanlig kemisk vejSyntesen af det potente antibiotikum thiostrepton bruger et radikalt SAM-protein TsrM, hvis krystalstruktur er vist til venstre, mens den er bundet til en jern-svovl-klynge og cobalamin. Nye billede -
 Forskere tuner materialers farve og termiske egenskaber separatDe visuelle og termiske egenskaber af polyethylen kan justeres til at producere farverige film med en bred vifte af varme-udstrålende egenskaber. Kredit:Felice Frankel Farven på et materiale kan o
Forskere tuner materialers farve og termiske egenskaber separatDe visuelle og termiske egenskaber af polyethylen kan justeres til at producere farverige film med en bred vifte af varme-udstrålende egenskaber. Kredit:Felice Frankel Farven på et materiale kan o
- MOF datasæt giver 10, 000 strukturer gratis til akademisk forskning
- Meget ledende og elastisk nanomembran til hudelektronik
- Udenlandske studerende frygter udvisning på grund af trussel om Trump-visum
- Billede:Eroderede lag i Shalbatana Valles
- Parker Solar Probe bliver slynget af hyperhastighedsstøv. Kan det beskadige rumfartøjet?
- Rapporten afslører en voksende trussel om cyberangreb mod fødevaresikkerheden


