Hvad betyder, at det kan fungere som en syre eller base?
Det betyder, at de enten kan donere eller tage imod protoner, alt efter hvilket miljø de befinder sig i.
I et surt miljø vil de fungere som en base og acceptere protoner.
I et basismiljø vil de fungere som en syre og donere protoner.
For eksempel er vand et amfotert stof. I rent vand er der lige mange hydrogenioner (H+) og hydroxidioner (OH-). Det skyldes, at vand kan gennemgå en selvioniseringsproces, hvor et vandmolekyle spaltes i en brintion og en hydroxidion. Når vand blandes med en syre, vil hydrogenionerne fra syren reagere med hydroxidionerne fra vandet og danne flere vandmolekyler. Dette vil mindske antallet af hydroxidioner i vandet og gøre opløsningen mere sur. Når vand blandes med en base, vil hydroxidionerne fra basen reagere med hydrogenionerne fra vandet og danne flere vandmolekyler. Dette vil mindske antallet af hydrogenioner i vandet og gøre opløsningen mere basisk.
 Varme artikler
Varme artikler
-
 Sjældne jordarters elementer i mineindustriens affaldsbunkerWenzhong Zhang er miljøforkæmper fra Helsinki Universitet, der i sin doktorafhandling inden for kemien beskriver en metode til at opfange små mængder sjældne jordarters grundstoffer fra aluminiumsindu
Sjældne jordarters elementer i mineindustriens affaldsbunkerWenzhong Zhang er miljøforkæmper fra Helsinki Universitet, der i sin doktorafhandling inden for kemien beskriver en metode til at opfange små mængder sjældne jordarters grundstoffer fra aluminiumsindu -
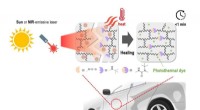 Beskyttende belægningsmateriale heler sig selv på 30 minutter, når det udsættes for sollysSelvhelbredende mekanisme af miljøvenligt beskyttende belægningsmateriale til køretøjer inklusive dynamisk polymernetværk og fototermisk farvestof. Kredit:Korea Research Institute of Chemical Technolo
Beskyttende belægningsmateriale heler sig selv på 30 minutter, når det udsættes for sollysSelvhelbredende mekanisme af miljøvenligt beskyttende belægningsmateriale til køretøjer inklusive dynamisk polymernetværk og fototermisk farvestof. Kredit:Korea Research Institute of Chemical Technolo -
 Solbrint:Lad os overveje stabiliteten af fotoelektroderSkalerbart stort område BiVO 4 fotoanode på FTO med Ni strømaftagere. Kredit:HZB Brint er et alsidigt brændstof, der kan lagre og frigive kemisk energi, når det er nødvendigt. Brint kan producer
Solbrint:Lad os overveje stabiliteten af fotoelektroderSkalerbart stort område BiVO 4 fotoanode på FTO med Ni strømaftagere. Kredit:HZB Brint er et alsidigt brændstof, der kan lagre og frigive kemisk energi, når det er nødvendigt. Brint kan producer -
 Fra flydende til fast for at drive udviklingen af membranløse organelleroskar RNP-granulat skal være i fast tilstand for at Drosophila-embryoet kan udvikle sig korrekt (til venstre). Hvis granulatet er i flydende tilstand, forstyrres de forventede udviklingsmønstre (til h
Fra flydende til fast for at drive udviklingen af membranløse organelleroskar RNP-granulat skal være i fast tilstand for at Drosophila-embryoet kan udvikle sig korrekt (til venstre). Hvis granulatet er i flydende tilstand, forstyrres de forventede udviklingsmønstre (til h
- Boeings leverancer falder igen i august
- Kvantecomputere bliver bærbare
- Hvorfor farlige asteroider på vej til Jorden er så svære at opdage
- Japanske forhandlere opkræver betaling for plastposer fra 2020
- Billede:Washington D.C. fra kredsløb
- En blanding af bittesmå guld- og viruspartikler - og de DNA-bånd, der binder dem


