Hvad får du, når du brænder CH4 i O2?
CH4 + 2O2 -> CO2 + 2H2O
Når metan brænder i nærværelse af ilt, gennemgår det en kemisk reaktion, der producerer kuldioxid (CO2) og vand (H2O). Denne reaktion er meget eksoterm, hvilket betyder, at den frigiver en betydelig mængde varmeenergi. Den varmeenergi, der frigives ved forbrænding af metan, er det, der gør det til en værdifuld brændstofkilde.
Den fuldstændige forbrænding af metan kræver et støkiometrisk forhold på 1 mol methan til 2 mol ilt. Men i praktiske applikationer bruges overskydende luft ofte til at sikre fuldstændig forbrænding og forhindre dannelsen af skadelige forurenende stoffer som kulilte (CO) og uforbrændte kulbrinter (HC).
Sidste artikelHvad er bindingen mellem et fast stof?
Næste artikelHvilke fysiske egenskaber skal materialet have for pengesedlen?
 Varme artikler
Varme artikler
-
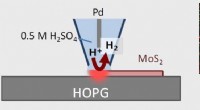 Billedbehandlingsteknik giver katalytisk 2-D materialeteknik et bedre udsynScanning elektrokemisk cellemikroskopi (SECCM) muliggør billeddannelse og kvantitativ analyse af hydrogenudviklingsreaktion (HER) katalytisk aktive steder i 1H MoS 2 monolag. Kredit:Kanazawa Univers
Billedbehandlingsteknik giver katalytisk 2-D materialeteknik et bedre udsynScanning elektrokemisk cellemikroskopi (SECCM) muliggør billeddannelse og kvantitativ analyse af hydrogenudviklingsreaktion (HER) katalytisk aktive steder i 1H MoS 2 monolag. Kredit:Kanazawa Univers -
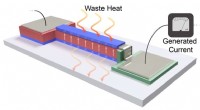 Tynd film omdanner varme fra elektronik til energiEn illustration af, hvordan tynd-film enhedssystemet omdanner spildvarme til energi. Kredit:Shishir Pandya Næsten 70 procent af den energi, der produceres i USA hvert år, går til spilde som varme.
Tynd film omdanner varme fra elektronik til energiEn illustration af, hvordan tynd-film enhedssystemet omdanner spildvarme til energi. Kredit:Shishir Pandya Næsten 70 procent af den energi, der produceres i USA hvert år, går til spilde som varme. -
 Ny analyse finder en ny mekanisme bag ældning af røde blodlegemerKredit:CC0 Public Domain Røde blodlegemer er den hyppigst forekommende celletype i blodet, transporterer ilt gennem hele menneskekroppen. I blodcirkulationen, de støder gentagne gange på forskelli
Ny analyse finder en ny mekanisme bag ældning af røde blodlegemerKredit:CC0 Public Domain Røde blodlegemer er den hyppigst forekommende celletype i blodet, transporterer ilt gennem hele menneskekroppen. I blodcirkulationen, de støder gentagne gange på forskelli -
 Højt nitrogen og svovl dobbelt-dopede kulstofmikrosfærer til superkondensatorerDenne figur viser morfologien, molekylær model og cyklisk ydeevne af den N/S co-doterede kulstofmikrosfære. Kredit:©Science China Press Blandt elektrodematerialer til superkondensatorer, kulstofba
Højt nitrogen og svovl dobbelt-dopede kulstofmikrosfærer til superkondensatorerDenne figur viser morfologien, molekylær model og cyklisk ydeevne af den N/S co-doterede kulstofmikrosfære. Kredit:©Science China Press Blandt elektrodematerialer til superkondensatorer, kulstofba
- Hvordan man opbygger en rhombus med et kompas og ret Edge
- Undersøgelse afslører hemmeligheder ved væskelignende varmestrøm i fast halvleder på nanoskala
- Hvad ville Apples fremtid være uden Steve Jobs?
- Hvem studerer forholdet mellem organismer og deres miljø?
- Hvad er udledningen af flydende affald fra kroppen?
- NASA finder den nye tropiske storm Iselle, der allerede kæmper mod vindskydning


