Hvad er afstanden mellem kerner af forskellige bindinger?
- Enkeltbinding (C-C):~1,54 Å
- Dobbeltbinding (C=C):~1,34 Å
- Tredobbelt binding (C≡C):~1,20 Å
Ioniske bindinger:
- Typisk mellem 2,0 og 5,0 Å, afhængig af de involverede ioner.
Hydrogenbindinger:
- Typisk mellem 1,5 og 3,0 Å, afhængig af donor- og acceptoratomer.
Metallige bindinger:
- Ikke veldefineret på grund af den delokaliserede natur af valenselektroner i metaller, men typisk omkring 2,5 Å for overgangsmetaller.
van der Waals-interaktioner:
- Typisk mellem 3,0 og 5,0 Å, afhængig af de involverede atomer eller molekyler.
 Varme artikler
Varme artikler
-
 Multipel myrelignende transport af neuronal last med motorproteinerGodstransport med mange motorer gør neuronal aktivitet fin. Kredit:Kumiko Hayashi Mikrotubuli er veje lavet af proteiner, der strækker sig gennem en celle for motorproteiner (bærere) til at levere
Multipel myrelignende transport af neuronal last med motorproteinerGodstransport med mange motorer gør neuronal aktivitet fin. Kredit:Kumiko Hayashi Mikrotubuli er veje lavet af proteiner, der strækker sig gennem en celle for motorproteiner (bærere) til at levere -
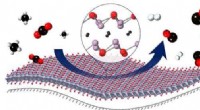 Katalysator for bæredygtig gassynteseEn tynd film af metaloxycarbider på en oxidbærer letter reaktionen mellem CO 2 og methan (CH4) til fremstilling af hydrogen (H2) og kulilte (CO). Kredit:Alexey Kurlov, Evgenia Deeva / ETH Zürich
Katalysator for bæredygtig gassynteseEn tynd film af metaloxycarbider på en oxidbærer letter reaktionen mellem CO 2 og methan (CH4) til fremstilling af hydrogen (H2) og kulilte (CO). Kredit:Alexey Kurlov, Evgenia Deeva / ETH Zürich -
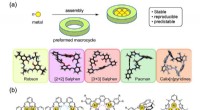 Metalliske komplekser lavet af cykliske molekylerModerne makrocykler brugt til syntese af diskrete polymetalliske komplekser:(a) koncept, (b) kemiske strukturer af repræsentative polymetalliske komplekser. Kredit:Kanazawa University I polymetall
Metalliske komplekser lavet af cykliske molekylerModerne makrocykler brugt til syntese af diskrete polymetalliske komplekser:(a) koncept, (b) kemiske strukturer af repræsentative polymetalliske komplekser. Kredit:Kanazawa University I polymetall -
 Samarbejde skaber et gennembrud for bæredygtig elektronikproduktionSFU Mechatronic Systems Engineering professor Woo Soo Kim samarbejder med schweiziske forskere om at udvikle en miljøvenlig 3D-printbar løsning til fremstilling af trådløse internet-of-Things-sensorer
Samarbejde skaber et gennembrud for bæredygtig elektronikproduktionSFU Mechatronic Systems Engineering professor Woo Soo Kim samarbejder med schweiziske forskere om at udvikle en miljøvenlig 3D-printbar løsning til fremstilling af trådløse internet-of-Things-sensorer
- Hvorfor er mit hjem blevet overrendt af spisekammermøl, og hvordan slipper jeg af med dem?
- 3-D Jorden undervejs
- Forskere har opdaget oprindelsen til livets byggesten
- Kunne mennesker fremtvinge et vulkanudbrud?
- Hvorfor står Kina over for rekordoversvømmelser?
- Rapporten undersøger forskydning af toppene af elforbruget via tre husholdningsapparater


