Hvad er ammoniakformen?
Sidste artikelHvad er funktionen af gaskromatograf?
Næste artikelHvorfor betragtes brint og ilt som grundstoffer?
 Varme artikler
Varme artikler
-
 Højtydende elektrokatalysatorer til at drive udviklingen af direkte ethanolbrændselscellerKombinerer kerne-skal-konstruktion med en legeringseffekt for at øge palladiums katalytiske ydeevne i ethanoloxidationsreaktioner. Kredit:YANG Jun Forskere fra Institute of Process Engineering (IP
Højtydende elektrokatalysatorer til at drive udviklingen af direkte ethanolbrændselscellerKombinerer kerne-skal-konstruktion med en legeringseffekt for at øge palladiums katalytiske ydeevne i ethanoloxidationsreaktioner. Kredit:YANG Jun Forskere fra Institute of Process Engineering (IP -
 Svovlindhold i nogle højtydende stoffer svækker dem, når de udsættes for fugtPh.d.-studerende Saiful Hoque ledede ny forskning, der kunne vise vejen til at udvikle stærkere, sikrere beskyttelsestøj til brandmænd og andre arbejdere. Kredit:University of Alberta Forskere har
Svovlindhold i nogle højtydende stoffer svækker dem, når de udsættes for fugtPh.d.-studerende Saiful Hoque ledede ny forskning, der kunne vise vejen til at udvikle stærkere, sikrere beskyttelsestøj til brandmænd og andre arbejdere. Kredit:University of Alberta Forskere har -
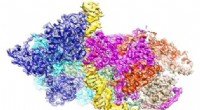 Højopløsningsbillede af strukturen af oprindelsesgenkendelseskomplekset bundet til DNA afsløretSide- (Orc1/2) og bundbillede (WHD) af ORC-DNA-komplekset (72-bp). Kredit:Division of Life Science, Hong Kong University of Science and Technology Celler formerer sig ved at lave kopier af sig sel
Højopløsningsbillede af strukturen af oprindelsesgenkendelseskomplekset bundet til DNA afsløretSide- (Orc1/2) og bundbillede (WHD) af ORC-DNA-komplekset (72-bp). Kredit:Division of Life Science, Hong Kong University of Science and Technology Celler formerer sig ved at lave kopier af sig sel -
 Belysning af måden at skifte kemiske reaktionsvejeForskere brugte grøn laser til at modulere reaktiviteten af triazolinediones (TADer), kraftfulde kemiske koblingsmidler. Kredit:QUT Kunne fremstillingen af de integrerede kredsløb og chips til
Belysning af måden at skifte kemiske reaktionsvejeForskere brugte grøn laser til at modulere reaktiviteten af triazolinediones (TADer), kraftfulde kemiske koblingsmidler. Kredit:QUT Kunne fremstillingen af de integrerede kredsløb og chips til
- Nyt Huawei -håndsæt til lancering uden Google -apps
- Hvad hvis du drikker blegemiddel?
- Curiosity rover finder pletter af rockplade slettet, afslørende spor
- Koordinationspolymerkrystaller viser lovende som ny generation af lyskilder til industri, medicin
- Rumfartøjsmålinger afslører mekanismen for solvindopvarmning
- Forskelle mellem en Boa, Python & Anaconda


