Hvor forskellige metaller producerer flammer i forskellige farver, når de brændes i ilt?
Her er grundene til, at metaller udviser forskellige flammefarver:
1. Elektronisk konfiguration :De elektroniske konfigurationer af metaller bestemmer deres excitationsenergier. Metaller med løst bundne valenselektroner (lav ioniseringsenergi) har en tendens til at udsende længere bølgelængde, lavere energifotoner, hvilket resulterer i farver mod den røde ende af spektret. Metaller med tæt bundne valenselektroner (høj ioniseringsenergi) udsender fotoner med kortere bølgelængde og højere energi og producerer farver mod den blå eller violette ende af spektret.
2. Atomstruktur og binding :Metallers krystalstruktur, atomstørrelse og bindingsegenskaber påvirker også flammens farve. Interaktionerne mellem metalatomer og de omgivende iltmolekyler under forbrænding påvirker energiniveauerne og overgangene af de exciterede elektroner, hvilket fører til variationer i farve.
3. Vibrations- og rotationsenerginiveauer :Ud over elektroniske overgange kan vibrationer og rotationer af molekyler inde i flammen bidrage til den overordnede flammefarve. Forskellige metaller producerer flammer med forskellige temperaturer, som påvirker omfanget af vibrations- og rotationsexcitationer, hvilket resulterer i yderligere spektrale træk og farvevariationer.
4. Delvis forbrænding :Nogle metaller undergår ufuldstændig forbrænding, hvor der kun sker delvis oxidation, hvilket fører til dannelsen af forskellige kemiske arter i flammen. Disse kemiske arter kan udsende deres egne karakteristiske farver, hvilket bidrager til den samlede observerede flammefarve.
5. Renheder og forureninger :Tilstedeværelsen af urenheder og kontaminanter i metallet eller forbrændingsmiljøet kan også påvirke flammens farve. Sporelementer eller forbindelser i metallet kan introducere yderligere emissionslinjer eller spektralbånd, hvilket ændrer den opfattede flammefarve.
6. Temperatur :Når temperaturen på flammen stiger, øges energien af de udsendte fotoner, hvilket resulterer i et skift af flammens farve mod den blå ende af spektret. Højere temperaturer exciterer elektroner til højere energiniveauer, hvilket fører til emission af lys med kortere bølgelængde og højere energi.
Det er værd at bemærke, at de observerede farver måske ikke altid er rene spektrale farver, men kan fremstå som blandinger eller kombinationer på grund af tilstedeværelsen af flere emissionslinjer og overlapning af forskellige farver. Den nøjagtige flammefarve produceret af et bestemt metal kan variere afhængigt af eksperimentelle forhold, såsom brændstof-til-ilt-forhold, temperatur og omgivende atmosfære.
 Varme artikler
Varme artikler
-
 Miniature VVS sporer lægemiddeludvikling hurtigtKredit:Lidia Matesic Sydney-forsker Lidia Matesic har udviklet en teknik til at fremskynde udviklingen af nukleare lægemidler, så hospitaler ikke kun kan lave nuklearmedicin internt, men også sk
Miniature VVS sporer lægemiddeludvikling hurtigtKredit:Lidia Matesic Sydney-forsker Lidia Matesic har udviklet en teknik til at fremskynde udviklingen af nukleare lægemidler, så hospitaler ikke kun kan lave nuklearmedicin internt, men også sk -
 Faseovergange fører til nye avancerede materialerKredit:Pixabay/CC0 Public Domain Tro det eller ej, Stål har noget til fælles med bakterielle vedhæng:de kan begge gennemgå en særlig form for fysisk transformation, der forbliver forvirrende. Nu,
Faseovergange fører til nye avancerede materialerKredit:Pixabay/CC0 Public Domain Tro det eller ej, Stål har noget til fælles med bakterielle vedhæng:de kan begge gennemgå en særlig form for fysisk transformation, der forbliver forvirrende. Nu, -
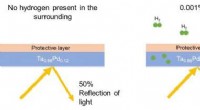 Forskere udvikler en alsidig brintsensorFigur 1. Skematisk illustration af, hvordan optiske brintsensorer fungerer. I nærheden af brint, det tantal- (Ta) og palladium- (Pd)-baserede materiale absorberer hydrogen (H). Jo større mængden af
Forskere udvikler en alsidig brintsensorFigur 1. Skematisk illustration af, hvordan optiske brintsensorer fungerer. I nærheden af brint, det tantal- (Ta) og palladium- (Pd)-baserede materiale absorberer hydrogen (H). Jo større mængden af -
 Personlige kræftvacciner:Leveringsgennembrud kan give bedre resultaterKredit:Ecole Polytechnique Federale de Lausanne Den eneste terapeutiske cancervaccine på markedet har indtil videre vist meget begrænset effekt i kliniske forsøg. EPFL-forskere arbejder i øjeblikk
Personlige kræftvacciner:Leveringsgennembrud kan give bedre resultaterKredit:Ecole Polytechnique Federale de Lausanne Den eneste terapeutiske cancervaccine på markedet har indtil videre vist meget begrænset effekt i kliniske forsøg. EPFL-forskere arbejder i øjeblikk
- Glemt antioxidanterne? Forskere sår tvivl om frie radikalers rolle i aldring
- Hvordan missilforsvarssystemer vil fungere
- Amerikanske astronauters erindringer giver et stumt billede af året i rummet
- Hvorfor du ikke bør se på en solformørkelse uden øjenbeskyttelse
- Raket udviklet af Japan opstart i flammer efter liftoff
- Kæmpe reduktion af varmeledning observeret i flade siliciumkanaler


