Hvorfor falder pH i en opløsning ved fortynding?
1. Stærke syrer og baser:
- Stærke syrer og baser dissocierer fuldstændigt i vand og frigiver alle deres henholdsvis hydrogenioner (H+) og hydroxidioner (OH-).
- Ved fortynding falder koncentrationen af både H+ og OH- ioner. Men da dissociationen er fuldstændig, forbliver de relative andele af H+ og OH-ioner de samme. Derfor forbliver pH-værdien af en stærk syre- eller baseopløsning stort set uændret ved fortynding.
2. Svage syrer:
- Svage syrer dissocierer delvist i vand og frigiver en lille del af deres hydrogenioner (H+).
- Ved fortynding øges dissociationen af den svage syre. Dette skyldes, at faldet i koncentrationen flytter ligevægten mod produkterne (H+ og den konjugerede base).
- Når koncentrationen af H+ ioner stiger ved fortynding, falder pH i en svag syreopløsning.
3. Svage baser:
- Svage baser dissocierer delvist i vand og frigiver en lille del af deres hydroxidioner (OH-).
- Ved fortynding øges dissociationen af den svage base. Dette skyldes, at koncentrationsfaldet flytter ligevægten mod produkterne (OH- og den konjugerede syre).
- Når koncentrationen af OH-ioner stiger ved fortynding, stiger pH-værdien af en svag baseopløsning.
4. Neutrale løsninger:
- Neutrale opløsninger har lige store koncentrationer af H+ og OH-ioner, hvilket resulterer i en pH på 7.
- Ved fortynding falder koncentrationerne af både H+ og OH- ioner, men deres relative andele forbliver de samme. Derfor forbliver pH-værdien af en neutral opløsning uændret ved fortynding.
Sammenfattende afhænger ændringen i pH ved fortynding af omfanget af dissociation af det opløste stof. Stærke syrer og baser viser minimale ændringer i pH, svage syrer viser et fald i pH, svage baser viser en stigning i pH, og neutrale opløsninger bevarer deres pH ved fortynding.
Sidste artikelHvordan dannes en ionforbindelse?
Næste artikelHvilket molekylært fast stof ville have det laveste kogepunkt?
 Varme artikler
Varme artikler
-
 Efter et århundredes søgen, forskere finder ny flydende faseFarverne i denne nyopdagede fase af flydende krystal skifter, mens forskere anvender et lille elektrisk felt. Kredit:SMRC Forskere ved University of Colorado Boulders Soft Materials Research Cente
Efter et århundredes søgen, forskere finder ny flydende faseFarverne i denne nyopdagede fase af flydende krystal skifter, mens forskere anvender et lille elektrisk felt. Kredit:SMRC Forskere ved University of Colorado Boulders Soft Materials Research Cente -
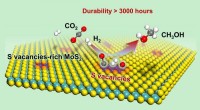 Katalytisk hydrogenering af kuldioxid til methanolForskere opnåede for første gang lavtemperatur højeffektiv hydrogenering af CO2 til methanol, med et langt arbejdsliv over svovlfri stillingsrige fålags MoS2, samt bemærkelsesværdigt højere aktivitet
Katalytisk hydrogenering af kuldioxid til methanolForskere opnåede for første gang lavtemperatur højeffektiv hydrogenering af CO2 til methanol, med et langt arbejdsliv over svovlfri stillingsrige fålags MoS2, samt bemærkelsesværdigt højere aktivitet -
 Anioner og kationer i dual-ion batterier fungerer som kohyrde og væverpigeAnioner og kationer i DIBer fungerer som Kohyrden og Væverpigen. Kredit:TANG Yongbing Dual-ion batterier (DIBer), hvor både kationer og anioner er involveret i den elektrokemiske redoxreaktion, om
Anioner og kationer i dual-ion batterier fungerer som kohyrde og væverpigeAnioner og kationer i DIBer fungerer som Kohyrden og Væverpigen. Kredit:TANG Yongbing Dual-ion batterier (DIBer), hvor både kationer og anioner er involveret i den elektrokemiske redoxreaktion, om -
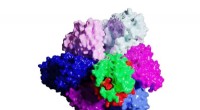 Forskere visualiserer bakteriemotoren i første skridt mod menneskeskabt elektrisk energiKrystalstrukturen af den molekylære motor V1 (ovenfra). Kredit:Institut for Molekylær Videnskab mennesker, en dag, kan være i stand til at producere deres egen elektrisk energi på samme måde som
Forskere visualiserer bakteriemotoren i første skridt mod menneskeskabt elektrisk energiKrystalstrukturen af den molekylære motor V1 (ovenfra). Kredit:Institut for Molekylær Videnskab mennesker, en dag, kan være i stand til at producere deres egen elektrisk energi på samme måde som
- Hvilken type elektroner beskæftiger ionbindinger sig med?
- At leve og ikke leve ting i økosystemet
- Taranteltågen burde ikke danne stjerner. Hvad sker der?
- Sort kulstof og anden forurening frø skyer. Var lige begyndt at forstå klimakonsekvenserne
- Ny kvantesensor kan forbedre kræftbehandlingen
- Gamle mikrometeoroider bar pletter af stjernestøv, vand til asteroide 4 Vesta


