Hvordan danner cl-atom en binding med hydrogenatom?
I tilfælde af Cl og H er Cl-atomet mere elektronegativt end H-atomet, så det tiltrækker det delte elektronpar stærkere. Dette skaber en polær kovalent binding, hvor Cl-atomet har en svag negativ ladning og H-atomet har en svag positiv ladning.
Dannelsen af en kovalent binding mellem et Cl-atom og et H-atom kan repræsenteres ved hjælp af en Lewis-struktur. I en Lewis-struktur er valenselektronerne af hvert atom repræsenteret af prikker, og linjer repræsenterer bindinger mellem atomer. Lewis-strukturen for HCl er:
```
H:Cl:
```
I denne Lewis-struktur repræsenterer den enkelte linje mellem H- og Cl-atomerne den kovalente binding mellem dem. De to prikker på Cl-atomet repræsenterer de to valenselektroner, som det deler med H-atomet.
Dannelsen af en kovalent binding mellem et Cl-atom og et H-atom er en eksoterm proces, hvilket betyder, at den frigiver energi. Denne energi frigives, fordi atomerne opnår en mere stabil konfiguration, når de deler elektroner. Bindingsenergien i HCl-molekylet er 431 kJ/mol, hvilket er et mål for bindingens styrke.
Sidste artikelHvordan fanger du kondensvand fra saltvand?
Næste artikelDen selvbindende egenskab af kulstof kaldes som?
 Varme artikler
Varme artikler
-
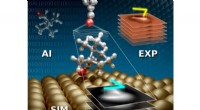 Ny tværfaglig tilgang til at identificere komplekse molekylære adsorbaterKunstig intelligens (AI) forbedret ab-initio struktursøgning kombineres med atomic force microscopy simulations (SIM) og eksperimenter (EXP) for at detektere konfigurationer af omfangsrige 3D-adsorbat
Ny tværfaglig tilgang til at identificere komplekse molekylære adsorbaterKunstig intelligens (AI) forbedret ab-initio struktursøgning kombineres med atomic force microscopy simulations (SIM) og eksperimenter (EXP) for at detektere konfigurationer af omfangsrige 3D-adsorbat -
 Lad det regne! Nye belægninger gør naturlige stoffer vandtætteAfvisning af forskellige væsker på polyesterstof belagt med H1F7Ma-co-DVB:sojasovs (sort dråbe), kaffe (brun dråbe), HCl -syre (øverste venstre gennemsigtige dråbe), NaOH (gennemsigtig dråbe nederst t
Lad det regne! Nye belægninger gør naturlige stoffer vandtætteAfvisning af forskellige væsker på polyesterstof belagt med H1F7Ma-co-DVB:sojasovs (sort dråbe), kaffe (brun dråbe), HCl -syre (øverste venstre gennemsigtige dråbe), NaOH (gennemsigtig dråbe nederst t -
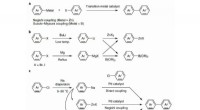 Kemikere viser, at natrium sikkert kan bruges til krydskoblingsreaktionerFremstilling af organometalliske forbindelser og de efterfølgende krydskoblingsreaktioner. en, Overgangsmetal-katalyserede krydskoblingsreaktioner. b, Almindelige metoder til fremstilling af organozin
Kemikere viser, at natrium sikkert kan bruges til krydskoblingsreaktionerFremstilling af organometalliske forbindelser og de efterfølgende krydskoblingsreaktioner. en, Overgangsmetal-katalyserede krydskoblingsreaktioner. b, Almindelige metoder til fremstilling af organozin -
 Porøse krystaller binder fluorholdige drivhusgasserI baggrunden:lysmikroskopibilleder af enkeltkrystalstrukturerne af den formfaste organiske burforbindelse. Foran:kugle-og-stik-model af enkeltkrystalstrukturen, grå:kulstof, hvid:brint, rød:oxygen, bl
Porøse krystaller binder fluorholdige drivhusgasserI baggrunden:lysmikroskopibilleder af enkeltkrystalstrukturerne af den formfaste organiske burforbindelse. Foran:kugle-og-stik-model af enkeltkrystalstrukturen, grå:kulstof, hvid:brint, rød:oxygen, bl
- Sådan diffuseres en laser Beam
- Effekten af aluminium dåser på miljøet
- Hvordan påvirker temperaturen det barometriske tryk?
- Hvordan tændes maggots til fluer?
- Processen fjerner samtidigt giftige metaller og salt for at producere rent vand
- Simuleringer viser, at en enkelt foton kan excitere to atomer samtidigt


