Hvordan adskiller ammoniak sig fra natriumhydroxid?
1. Kemisk sammensætning :
- Ammoniak (NH3) er en kovalent forbindelse bestående af tre hydrogenatomer bundet til et centralt nitrogenatom. Det er en gas ved stuetemperatur og tryk.
- Natriumhydroxid (NaOH) er en ionforbindelse sammensat af positivt ladede natriumioner (Na+) og negativt ladede hydroxidioner (OH-). Det er et hvidt, krystallinsk fast stof ved stuetemperatur.
2. Opløselighed :
- Ammoniak er meget opløseligt i vand og danner ammoniumhydroxid (NH4OH), en svag base.
- Natriumhydroxid er også meget opløseligt i vand og opløses i natriumioner (Na+) og hydroxidioner (OH-), hvilket gør det til en stærk base.
3. pH :
- Ammoniak opløsninger har en let basisk pH, typisk mellem 9 og 10. Dette skyldes, at når de opløses i vand, reagerer en lille portion ammoniak med vand og danner hydroxidioner.
- Natriumhydroxid opløsninger har en stærkt basisk pH, typisk over 12. Dette skyldes, at natriumhydroxid dissocierer fuldstændigt i vand og frigiver en høj koncentration af hydroxidioner.
4. Ætsende :
- Ammoniak er ikke stærkt ætsende, medmindre det er i meget høje koncentrationer. Det kan dog forårsage irritation af luftvejene og hudforbrændinger, hvis det håndteres forkert.
- Natriumhydroxid er et ætsende stof, der kan forårsage alvorlige forbrændinger og skader på væv, hvis det kommer i kontakt med hud eller øjne.
5. Toksicitet :
- Ammoniak er giftig i høje koncentrationer, primært ved indånding. Det kan forårsage åndedrætsbesvær og endda død, hvis der opstår alvorlig eksponering.
- Natriumhydroxid er også giftig, især ved indtagelse eller kontakt med huden. Det kan forårsage alvorlige kemiske forbrændinger og vævsskader.
6. Bruger :
- Ammoniak har forskellige anvendelser, blandt andet som gødning i landbruget, et rengøringsmiddel og i produktionen af andre kemikalier.
- Natriumhydroxid er meget udbredt i industrier som sæbe- og vaskemiddelfremstilling, papirproduktion, tekstiler og vandbehandling.
Både ammoniak og natriumhydroxid er vigtige forbindelser med forskellige egenskaber, og der skal tages forholdsregler ved håndtering af dem på grund af deres potentielle farer.
 Varme artikler
Varme artikler
-
 Mikrofluidisk chip kan reducere bivirkninger ved strålebehandlingMikrovaskulaturen (blodkar -systemer i organer) dannet inde i chippen. Kredit:Joe Vittorio Organ-on-a-chip teknologi bruges til at udvikle 3D-modeller, der gør det muligt for forskere i det sydlig
Mikrofluidisk chip kan reducere bivirkninger ved strålebehandlingMikrovaskulaturen (blodkar -systemer i organer) dannet inde i chippen. Kredit:Joe Vittorio Organ-on-a-chip teknologi bruges til at udvikle 3D-modeller, der gør det muligt for forskere i det sydlig -
 Hvorfor barbering gør selv de skarpeste barbermaskiner sløveKredit:Unsplash/CC0 Public Domain Barbermaskiner, skalpeller, og knive er normalt fremstillet af rustfrit stål, slebet til en knivskarp kant og belagt med endnu hårdere materialer såsom diamantlig
Hvorfor barbering gør selv de skarpeste barbermaskiner sløveKredit:Unsplash/CC0 Public Domain Barbermaskiner, skalpeller, og knive er normalt fremstillet af rustfrit stål, slebet til en knivskarp kant og belagt med endnu hårdere materialer såsom diamantlig -
 Mærkelige ting sker, når en krystal er delt i toEn labyrintlignende struktur opstår på overfladen. Kredit:TU Wien Den bemærkelsesværdige styrke af ioniske krystaller er let forklaret på atomær skala:Positivt og negativt ladede atomer sidder sid
Mærkelige ting sker, når en krystal er delt i toEn labyrintlignende struktur opstår på overfladen. Kredit:TU Wien Den bemærkelsesværdige styrke af ioniske krystaller er let forklaret på atomær skala:Positivt og negativt ladede atomer sidder sid -
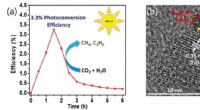 En-to-punch katalysatorer, der fanger kuldioxid til renere brændstofferBrændstofproduktionseffektivitet af titaniumdioxid fotokatalysator med kobber-platin legering co-katalysator (a) og et foto af fotokatalysator observeret af HRTEM (b) Kredit:©DGIST Kobber- og plat
En-to-punch katalysatorer, der fanger kuldioxid til renere brændstofferBrændstofproduktionseffektivitet af titaniumdioxid fotokatalysator med kobber-platin legering co-katalysator (a) og et foto af fotokatalysator observeret af HRTEM (b) Kredit:©DGIST Kobber- og plat
- Trykkeriinnovationer giver ti gange forbedring af organisk elektronik
- Vil salicylsyre opløses i citrat?
- Hvordan kunne tilsætning af kalk til havvand reducere atmosfærisk CO2?
- Diesel flyder ikke denne båd-team designer nulemissioner marine forskningsfartøjer
- IBM:Hvis AI-beslutningen skal ses nærmere, bliv vågen, og her er hvordan
- Find de faktorer, der påvirker stålkorrosionen mest i armeret beton mest


