Hvorfor udsender elementer lys med karakteristiske farve, når de fordampes?
Her er en forklaring på, hvorfor elementer udsender karakteristiske farver, når de fordampes:
1. Elektroniske overgange:Elektronerne i et atom optager forskellige energiniveauer eller elektronskaller rundt om kernen. Hvert element har et specifikt arrangement af elektroner i disse skaller, som bestemmer dets kemiske egenskaber og adfærd.
2. Energioptagelse:Når et grundstof opvarmes eller udsættes for en anden energikilde, optager atomerne energi. Denne energi absorberes af elektronerne, hvilket får dem til at bevæge sig fra deres grundtilstand (det laveste energiniveau) til exciterede tilstande (højere energiniveauer).
3. Retur til grundtilstand:Efter at have absorberet energi og nået exciterede tilstande, er elektronerne ustabile og har en tendens til at vende tilbage til deres grundtilstand for at opnå stabilitet. Under denne overgang frigiver elektronerne den overskydende energi i form af lysfotoner.
4. Karakteristisk farve:Elektronernes energiniveauer er specifikke for hvert grundstof. Forskellen i energi mellem den exciterede tilstand og grundtilstanden bestemmer bølgelængden og frekvensen af det udsendte lys. Da hvert element har sit eget karakteristiske arrangement af energiniveauer, udsender det lys af en bestemt bølgelængde, hvilket resulterer i observation af karakteristiske farver for forskellige elementer.
For eksempel, når natriumatomer fordampes, udsender de lys, der ser gult ud for vores øjne. Dette skyldes, at energiforskellen mellem den exciterede tilstand og grundtilstanden i natrium svarer til den gule del af det synlige spektrum. På samme måde udsender kobber et blågrønt lys, når det fordampes, og brint udsender et rødt lys.
Emissionen af karakteristiske farver fra fordampede elementer er en grundlæggende egenskab, der hjælper med den kvalitative identifikation af elementer i kemisk analyse, spektroskopi og andre relaterede områder.
Sidste artikelReagerer stærk syre med base?
Næste artikelHvilken type bindesalt har?
 Varme artikler
Varme artikler
-
 Ny lim kan gøre millioner af medicinske procedurer sikrere, mindre invasiv for patienterPurdue University lektor Julie Liu, til venstre, og doktorand Sydney Hollingshead hjalp med at skabe en lim, der kunne gøre medicinske procedurer sikrere. Kredit:Purdue University billede/Erin Easterl
Ny lim kan gøre millioner af medicinske procedurer sikrere, mindre invasiv for patienterPurdue University lektor Julie Liu, til venstre, og doktorand Sydney Hollingshead hjalp med at skabe en lim, der kunne gøre medicinske procedurer sikrere. Kredit:Purdue University billede/Erin Easterl -
 Forskere udvikler ultrastærke aerogeler med materialer, der bruges i skudsikre vesteAerogelerne har ønskværdige egenskaber såsom letvægts, semi-transparent og høj belastningsbærende evne. Kredit:University of Hong Kong Aerogeler er lette materialer med omfattende porer i mikroskal
Forskere udvikler ultrastærke aerogeler med materialer, der bruges i skudsikre vesteAerogelerne har ønskværdige egenskaber såsom letvægts, semi-transparent og høj belastningsbærende evne. Kredit:University of Hong Kong Aerogeler er lette materialer med omfattende porer i mikroskal -
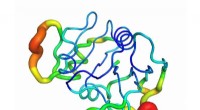 Gotcha! Forskere fingeraftryksproteiner ved hjælp af deres vibrationerEn illustration visualiserer dihydrofolatreduktase, et af de proteiner forskere undersøgte. Farverne angiver intensiteten af proteinets bevægelse forskellige steder, lige fra blå (mindre bevægelse)
Gotcha! Forskere fingeraftryksproteiner ved hjælp af deres vibrationerEn illustration visualiserer dihydrofolatreduktase, et af de proteiner forskere undersøgte. Farverne angiver intensiteten af proteinets bevægelse forskellige steder, lige fra blå (mindre bevægelse) -
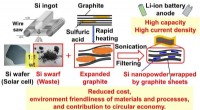 Fra skrald til skat:Siliciumaffald finder ny anvendelse i Li-ion-batterierFig. 1 Fremstilling af elektrode med Si-spåner/grafitpladekompositter (kredit:Osaka University) Li-ion-batterier (LIBer) er meget udbredt i mobilelektronik. Bekymringer for global opvarmning og kl
Fra skrald til skat:Siliciumaffald finder ny anvendelse i Li-ion-batterierFig. 1 Fremstilling af elektrode med Si-spåner/grafitpladekompositter (kredit:Osaka University) Li-ion-batterier (LIBer) er meget udbredt i mobilelektronik. Bekymringer for global opvarmning og kl
- Naturinspirerede materialer kan bruges i applikationer lige fra tunneling til rum
- Forsker afviser teori om spredning af mennesker i Europa
- Hvad er den økonomiske værdi af Great Barrier Reef? Det er uvurderligt
- Forskere opdager, hvordan og hvor brysttumorceller bliver i dvale, hvad der får dem til at metastas…
- Hvordan produceres neon?
- Hjerteceller reagerer på stive omgivelser


