Atomer holdes sammen med kovalent tiltrækning?
1. Kovalent binding:
- Ved kovalent binding deler atomer elektroner for at opnå en stabil elektronkonfiguration. De delte elektroner holdes i et område med høj elektrontæthed mellem atomernes kerner. Kovalente bindinger dannes typisk mellem ikke-metaller og resulterer i dannelsen af molekyler. For eksempel i vandmolekylet (H2O) holdes de to brintatomer og oxygenatomet sammen af kovalente bindinger.
2. Ionisk binding:
- Ionbinding opstår, når der er en fuldstændig overførsel af elektroner fra et atom til et andet, hvilket resulterer i dannelsen af positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Den elektrostatiske tiltrækning mellem de modsat ladede ioner holder den ioniske forbindelse sammen. Ionbindinger dannes typisk mellem et metal og et ikke-metal. For eksempel i natriumchlorid (NaCl) mister natrium en elektron til klor, hvilket resulterer i dannelsen af Na+ og Cl-ioner, som holdes sammen af ionbindinger.
3. Metallisk limning:
- Metallisk binding er en type kemisk binding, der opstår mellem metalatomer. Ved metallisk binding er de yderste elektroner af metalatomerne delokaliserede og frie til at bevæge sig gennem hele gitteret af metalatomer. Dette "hav" af delokaliserede elektroner holder metalatomerne sammen. Metalliske bindinger er ansvarlige for de karakteristiske egenskaber af metaller, såsom høj elektrisk og termisk ledningsevne, formbarhed og duktilitet.
Sammenfattende, mens kovalent tiltrækning er en betydelig type kemisk binding, der holder atomer sammen i molekyler, er det ikke den eneste type tiltrækning. Ionbinding og metallisk binding er også vigtige typer kemiske bindinger, der holder atomer sammen i forskellige typer forbindelser.
Sidste artikelHvad er den proces, der binder molekyler sammen?
Næste artikelHvad omfatter smeltning?
 Varme artikler
Varme artikler
-
 Kasserede cigaretskod - det næste højtydende brintopbevaringsmateriale?Kredit:University of Nottingham Kasserede cigaretskod er en stor affaldsbortskaffelse og miljøforureningsfare. Men kemikere ved University of Nottingham har opdaget, at cigaretskod-afledte carbone
Kasserede cigaretskod - det næste højtydende brintopbevaringsmateriale?Kredit:University of Nottingham Kasserede cigaretskod er en stor affaldsbortskaffelse og miljøforureningsfare. Men kemikere ved University of Nottingham har opdaget, at cigaretskod-afledte carbone -
 Sød! Sukkerbelagt probe giver bedre syretestHaiying Lius syrefølsomme selvlysende sonde lyser gradvist lysere i levende celler, efterhånden som pH falder, både under konventionel fluorescens (CF) og under enkelt-foton opkonverteringsluminescens
Sød! Sukkerbelagt probe giver bedre syretestHaiying Lius syrefølsomme selvlysende sonde lyser gradvist lysere i levende celler, efterhånden som pH falder, både under konventionel fluorescens (CF) og under enkelt-foton opkonverteringsluminescens -
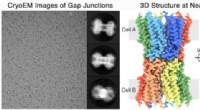 At låse op for hemmelighederne om, hvordan celler kommunikerer, giver indsigt i behandling af sygdo…2-D billeder, venstre, og 3D-strukturen, ret, af gap junction kommunikationskanalen fra øjenlinsen, løst til nær-atomisk opløsning af Reichow Lab ved hjælp af kryo-elektronmikroskopi Kredit:Reichow La
At låse op for hemmelighederne om, hvordan celler kommunikerer, giver indsigt i behandling af sygdo…2-D billeder, venstre, og 3D-strukturen, ret, af gap junction kommunikationskanalen fra øjenlinsen, løst til nær-atomisk opløsning af Reichow Lab ved hjælp af kryo-elektronmikroskopi Kredit:Reichow La -
 Gendriver en 70-årig tilgang til forudsigelse af materialemikrostrukturDen mørkeblå skygge repræsenterer en grænse, der adskiller to korn; som grænsen bevæger sig, bliver nogle elementer, der tilhører korn m, en del af korn n. Kredit:College of Engineering, Carnegie Mell
Gendriver en 70-årig tilgang til forudsigelse af materialemikrostrukturDen mørkeblå skygge repræsenterer en grænse, der adskiller to korn; som grænsen bevæger sig, bliver nogle elementer, der tilhører korn m, en del af korn n. Kredit:College of Engineering, Carnegie Mell
- Forskere afgør, hvordan svampe producerer forbindelser med potentielle farmaceutiske anvendelser
- Hvilken type kemisk binding danner aluminium?
- Forskning viser, at dyb lytning kan hjælpe med at bekæmpe klimaændringer
- Metoder til test af PH af væsker
- Internationalt forskerhold udvikler ultrahøjeffekt energilagringsenheder
- Nye test viser ingen pottekemikalier i Colorado bys vand


