Hvad sker der med kovalente bindinger Deres elektron?
I en kovalent binding er elektrontætheden koncentreret i området mellem de bundne atomer og danner det, der er kendt som en kovalent molekylær orbital. Denne molekylære orbital er et område, hvor sandsynligheden for at finde de delte elektroner er højest. Elektronerne i en kovalent binding er ikke statiske og bevæger sig kontinuerligt inden for den molekylære orbital, udveksler konstant positioner og indtager forskellige energitilstande.
Delingen af elektroner i kovalente bindinger gør det muligt for atomer at opnå en mere stabil elektronkonfiguration, der ofte ligner elektronarrangementet af ædelgasser. Dette elektrondelingsfænomen resulterer i dannelsen af stabile molekyler og forbindelser med unikke egenskaber og karakteristika.
Sidste artikelHVAD er den fysiske tilstand af eddikesyre ved stuetemperatur?
Næste artikelHvad er karakteristisk for en kovalent binding?
 Varme artikler
Varme artikler
-
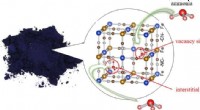 Et blåt pigment viste sig at være et højtydende ammoniakadsorbent(Figur):Preussisk blå (til venstre) og den preussiske blå krystalstruktur, der adsorberer ammoniakmolekyler (til højre). Kredit:Avanceret industriel videnskab og teknologi Akira Takahashi (forsker
Et blåt pigment viste sig at være et højtydende ammoniakadsorbent(Figur):Preussisk blå (til venstre) og den preussiske blå krystalstruktur, der adsorberer ammoniakmolekyler (til højre). Kredit:Avanceret industriel videnskab og teknologi Akira Takahashi (forsker -
 Lindring af antibiotikaresistens:Forskere tager skridt mod ny behandling af E. coliPhilip Hardwidge, professor i diagnostisk medicin og patobiologi ved Kansas State Universitys College of Veterinary Medicine, ret, og Samir El Qaidi, postdoc forsker, forsker i nye måder at behandle E
Lindring af antibiotikaresistens:Forskere tager skridt mod ny behandling af E. coliPhilip Hardwidge, professor i diagnostisk medicin og patobiologi ved Kansas State Universitys College of Veterinary Medicine, ret, og Samir El Qaidi, postdoc forsker, forsker i nye måder at behandle E -
 Hvordan forlænger man smøremidlernes brugstid?Uanset om det er i din bil eller en vindmølle, skum nedbryder det smøremiddel, der er nødvendigt for, at motorer kan arbejde effektivt. Kredit:Pixabay/phtorxp Vindmøller, der rager flere hundrede
Hvordan forlænger man smøremidlernes brugstid?Uanset om det er i din bil eller en vindmølle, skum nedbryder det smøremiddel, der er nødvendigt for, at motorer kan arbejde effektivt. Kredit:Pixabay/phtorxp Vindmøller, der rager flere hundrede -
 Forskning går til nye dybder i hudpeptidundersøgelserDavid Scurr, Seniorforsker, Farmaceutisk Skole. Kredit:University of Nottingham Forskere har for første gang afsløret, at et peptid i et førende skønhedsprodukt kan trænge ind i hudens hårde strat
Forskning går til nye dybder i hudpeptidundersøgelserDavid Scurr, Seniorforsker, Farmaceutisk Skole. Kredit:University of Nottingham Forskere har for første gang afsløret, at et peptid i et førende skønhedsprodukt kan trænge ind i hudens hårde strat


