Hvad gør et fast stof anderledes end flydende?
1. Bestemt form og volumen: Faste stoffer har en bestemt form og volumen. Deres partikler er tæt pakket og stærkt bundet og danner en stiv struktur, der modstår ændringer i form eller volumen. I modsætning hertil tager væsker formen af den beholder, de er i, og har et bestemt volumen, men ingen bestemt form. Deres partikler er mindre tæt pakket og kan bevæge sig mere frit, hvilket tillader væsker at flyde og tilpasse sig formen på deres beholder.
2. Intermolekylære kræfter: Styrken af intermolekylære kræfter mellem partikler er en afgørende faktor, der adskiller faste stoffer fra væsker. I faste stoffer holdes partiklerne sammen af stærke intermolekylære kræfter såsom kovalente bindinger, ionbindinger eller metalliske bindinger. Disse kræfter holder partiklerne fast i deres positioner, hvilket resulterer i en stiv struktur. I væsker er de intermolekylære kræfter svagere, såsom van der Waals-kræfter eller hydrogenbindinger. Disse svagere kræfter tillader partiklerne at bevæge sig mere frit, hvilket giver væsker deres flydende.
3. Partikelarrangement: Arrangementet af partikler i faste stoffer og væsker adskiller sig væsentligt. I faste stoffer er partikler arrangeret i et regelmæssigt, ordnet mønster, der ofte danner en krystallinsk struktur. Partiklerne i væsker er derimod arrangeret tilfældigt og har ikke et fast mønster. Denne forskel i partikelarrangement bidrager til de forskellige egenskaber af faste stoffer og væsker.
4. Tæthed: Faste stoffer er generelt tættere end væsker. Massefylde er defineret som massen pr. volumenhed. I faste stoffer optager de tætpakkede partikler et mindre volumen, hvilket resulterer i en højere densitet. Væsker, med deres mindre tætpakkede partikler, har en lavere densitet sammenlignet med de fleste faste stoffer.
5. Kompressibilitet: Faste stoffer er mindre komprimerbare end væsker. Kompressibilitet refererer til et stofs evne til at reducere dets volumen, når der påføres tryk. Faste stoffer har stærke intermolekylære kræfter, der modstår komprimering, hvilket gør dem svære at komprimere. Væsker, med deres svagere intermolekylære kræfter, er mere komprimerbare og kan let komprimeres, når der påføres tryk.
6. Diffusion: Diffusion er bevægelsen af partikler fra et område med højere koncentration til et område med lavere koncentration. I faste stoffer begrænser de stærke intermolekylære kræfter partiklernes bevægelse, hvilket resulterer i en langsom diffusionshastighed. Væsker har en højere diffusionshastighed på grund af de svagere intermolekylære kræfter og partiklernes evne til at bevæge sig mere frit.
7. Smeltning og frysning: Faste stoffer kan smeltes til væsker ved at anvende varme. Denne proces involverer at bryde de intermolekylære kræfter, der holder partiklerne sammen. Omvendt kan væsker omdannes til faste stoffer ved at fjerne varme, hvilket får partiklerne til at miste kinetisk energi og blive tættere pakket, hvilket fører til dannelsen af en fast struktur.
At forstå disse forskelle mellem faste stoffer og væsker er afgørende i forskellige videnskabelige discipliner og praktiske anvendelser. Ved at manipulere intermolekylære kræfter og temperatur bliver det muligt at kontrollere og modificere materialers egenskaber til ønskede formål.
Sidste artikelHvordan adskiller man kuldioxid for at få ilt?
Næste artikelHvad er funktionen af ligevægt?
 Varme artikler
Varme artikler
-
 Forskere designer organisk katode til højtydende batterierHovedforfatter Zulipiya Shadike (til højre) er afbilledet ved NSLS-IIs XPD-strålelinje sammen med videnskabsmand og medforfatter Sanjit Ghose (til venstre). Kredit:Brookhaven National Laboratory F
Forskere designer organisk katode til højtydende batterierHovedforfatter Zulipiya Shadike (til højre) er afbilledet ved NSLS-IIs XPD-strålelinje sammen med videnskabsmand og medforfatter Sanjit Ghose (til venstre). Kredit:Brookhaven National Laboratory F -
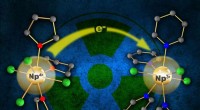 Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces
Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces -
 Kemiker forklarer videnskaben bag fyrværkeriUanset om du vil se fyrværkeri langs Bostons Esplanade eller et andet sted den fjerde juli, du vil ikke være den eneste, der slapper af denne ferie. Det er fordi fyrværkeri, forklarede Michael Pollas
Kemiker forklarer videnskaben bag fyrværkeriUanset om du vil se fyrværkeri langs Bostons Esplanade eller et andet sted den fjerde juli, du vil ikke være den eneste, der slapper af denne ferie. Det er fordi fyrværkeri, forklarede Michael Pollas -
 Team -afkodet molekylær mekanisme, der hæmmer sværmende motilitet hos bakteriepopulationerDr. Thomas Boettcher. Kredit:University of Konstanz I naturen, bakterier forekommer mest i multicellulære kollektiver, frem for som enkeltpersoner. De er i stand til at koordinere deres adfærd, me
Team -afkodet molekylær mekanisme, der hæmmer sværmende motilitet hos bakteriepopulationerDr. Thomas Boettcher. Kredit:University of Konstanz I naturen, bakterier forekommer mest i multicellulære kollektiver, frem for som enkeltpersoner. De er i stand til at koordinere deres adfærd, me


