Hvorfor reagerer gruppe 1 og 2 i det periodiske system let?
1. Lav ioniseringsenergi :
Disse grundstoffer har en lav ioniseringsenergi. Alkalimetaller (gruppe 1) har én valenselektron (ns1), mens jordalkalimetaller (gruppe 2) har to valenselektroner (ns2). Det er lettere for dem at miste disse valenselektroner, hvilket resulterer i dannelsen af positivt ladede ioner (kationer).
2. Danning af elektropositive ioner:
Når gruppe 1 og gruppe 2 elementer mister deres valenselektroner, får de en positiv ladning og bliver til elektropositive ioner. Elektropositive ioner er stærkt tiltrukket af elektronegative ioner, hvilket fører til dannelsen af forskellige kemiske forbindelser.
3. Høj reaktivitet med ikke-metaller:
Gruppe 1 og gruppe 2 elementer reagerer kraftigt med ikke-metaller for at fuldende deres valensskaller og opnå elektronisk stabilitet. For eksempel reagerer natrium (gruppe 1) med klorgas (et ikke-metal) for at danne natriumchlorid (NaCl), en ionisk forbindelse.
4. Reaktivitet og periodiske tendenser:
Bevæger man sig ned inden for gruppe 1 og 2, øges elementernes reaktivitet. Dette skyldes, at atomstørrelsen øges, og valenselektronerne er længere væk fra den positivt ladede kerne. Som et resultat er elektronerne mere løst holdt og lettere at fjerne, hvilket fører til øget reaktivitet.
5. Danning af stabile oxider og hydroxider:
Gruppe 1 og gruppe 2 elementer reagerer med ilt og vand for at danne stabile oxider og hydroxider. Alkalimetaller danner basiske oxider (f.eks. Na2O) og hydroxider (f.eks. NaOH), mens jordalkalimetaller danner mere stabile oxider (f.eks. CaO) og hydroxider (f.eks. Ca(OH)2).
6. Høje smelte- og kogepunkter:
Den stærke elektrostatiske tiltrækning mellem positivt ladede metalioner og negativt ladede ikke-metalioner resulterer i høje smelte- og kogepunkter for deres forbindelser. Denne egenskab er især udtalt i gruppe 1 og gruppe 2 forbindelser.
Sammenfattende kan gruppe 1 og 2 elementers høje tendens til at reagere og danne forbindelser tilskrives deres lave ioniseringsenergier, dannelsen af elektropositive ioner, deres reaktivitet med ikke-metaller og stabiliteten af deres oxider og hydroxider. Disse egenskaber spiller en afgørende rolle i deres brede vifte af anvendelser, herunder brug som reduktionsmidler, som kilder til metalioner i biologiske processer og i produktionen af forskellige industrielle kemikalier.
Sidste artikelHvilket grundstof findes i kul eller diamanter?
Næste artikelHNO3 er et eksempel på en blanding eller opløsning?
 Varme artikler
Varme artikler
-
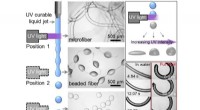 Høst af mikropartikler fra en flydende stråleAfhængigt af placeringen af UV -bestrålingen af væskestrålen, fibre, beaded fibre eller mikropartikler dannes. Kredit:University of Twente Mikrosfærer, mikrolinser og mikrofibre kan nu fremsti
Høst af mikropartikler fra en flydende stråleAfhængigt af placeringen af UV -bestrålingen af væskestrålen, fibre, beaded fibre eller mikropartikler dannes. Kredit:University of Twente Mikrosfærer, mikrolinser og mikrofibre kan nu fremsti -
 Robuste og billige katalysatorer til brintproduktionHoldet fra Bochum i laboratoriet:Tsvetan Tarnev, Corina Andronescu og Mathias Smialkowski (fra venstre). Kredit:RUB, Marquard Forskere fra Ruhr University Bochum (RUB) og University of Warwick var
Robuste og billige katalysatorer til brintproduktionHoldet fra Bochum i laboratoriet:Tsvetan Tarnev, Corina Andronescu og Mathias Smialkowski (fra venstre). Kredit:RUB, Marquard Forskere fra Ruhr University Bochum (RUB) og University of Warwick var -
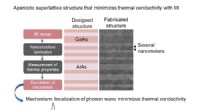 Minimering af termisk ledningsevne af krystallinsk materiale med optimal nanostrukturDen optimale nanostruktur designet med MI (aperiodisk supergitterstruktur) blev faktisk fremstillet, og den optimale ydeevne blev verificeret ved at vurdere dens varmeledningsevne. Figur:Den faktiske
Minimering af termisk ledningsevne af krystallinsk materiale med optimal nanostrukturDen optimale nanostruktur designet med MI (aperiodisk supergitterstruktur) blev faktisk fremstillet, og den optimale ydeevne blev verificeret ved at vurdere dens varmeledningsevne. Figur:Den faktiske -
 Forsker gør beskidt stanniol til biobrændstofkatalysatorAhmed Osman. Kredit:Queens University Belfast En forsker ved Queens University Belfast har opdaget en måde at omdanne snavset aluminiumsfolie til en biobrændstofkatalysator, som kunne være med til
Forsker gør beskidt stanniol til biobrændstofkatalysatorAhmed Osman. Kredit:Queens University Belfast En forsker ved Queens University Belfast har opdaget en måde at omdanne snavset aluminiumsfolie til en biobrændstofkatalysator, som kunne være med til
- Online dating vil sandsynligvis få et løft fra pandemi, siger sociolog
- NASa ser rester af irma klar til at forlade det østlige USA
- Sådan Multipliceres Vectors
- Felteksperiment finder en simpel ændring, der kunne øge landbrugets produktivitet med 60 %
- Undersøgelse beskriver uoverensstemmelser i, hvordan forskellige jordsystemmodeller forudsiger jord…
- Hvilke metoder brugte Watson og crick til at bestemme strukturen af DNA?


