Hvordan reagerer methanol med vand?
CH3OH + H2O → CH3OH2+ + OH-
I denne reaktion donerer methanolmolekylet en proton (H+) til vandmolekylet, hvilket resulterer i dannelsen af en hydroniumion (CH3OH2+) og en hydroxidion (OH-). Hydroniumionen er i det væsentlige et protoneret methanolmolekyle, mens hydroxidionen er en fri hydroxylgruppe.
I hvilket omfang methanol undergår hydrolyse afhænger af flere faktorer, herunder temperaturen, koncentrationen af syrekatalysatoren og tilstedeværelsen af andre reaktanter eller opløsningsmidler. Under normale forhold er hydrolysen af methanol en relativt langsom reaktion. Det kan dog accelereres ved at øge temperaturen eller ved at bruge en stærkere syrekatalysator.
Produkterne fra hydrolysereaktionen, hydroniumioner og hydroxidioner, kan yderligere reagere med hinanden eller med andre reaktanter til stede i opløsningen. For eksempel, i nærvær af en stærk base, såsom natriumhydroxid (NaOH), vil hydroniumionerne reagere med hydroxidionerne for at danne vand, mens methanolen forbliver uomsat.
CH3OH2+ + OH- → CH3OH + H2O
Overordnet set er reaktionen mellem methanol og vand en reversibel proces, og ligevægten mellem methanol, hydroniumioner og hydroxidioner kan forskydes afhængigt af reaktionsbetingelserne.
Sidste artikelBliver syrer rødt litimuspapir?
Næste artikelHvordan kan saltsyre blive rød i farven?
 Varme artikler
Varme artikler
-
 Spinout søger at omdanne test af fødevaresikkerhedJanus-emulsionsdråber fanges i færd med at ændre form som reaktion på tilstedeværelsen af forurening med et fødevarepatogen i et laboratoriemiljø. Emulsionerne kan ses med det blotte øje og, ved hjæ
Spinout søger at omdanne test af fødevaresikkerhedJanus-emulsionsdråber fanges i færd med at ændre form som reaktion på tilstedeværelsen af forurening med et fødevarepatogen i et laboratoriemiljø. Emulsionerne kan ses med det blotte øje og, ved hjæ -
 Fødevareingrediensblandinger mere følsomme over for klimaændringer, undersøgelse finderMauers laboratorieforskning afslører, at fugtsorption i fødevareblandinger er mere følsomme over for klimaændringer end enkelte ingredienser. Kredit:Purdue Department of Food Science foto En nylig
Fødevareingrediensblandinger mere følsomme over for klimaændringer, undersøgelse finderMauers laboratorieforskning afslører, at fugtsorption i fødevareblandinger er mere følsomme over for klimaændringer end enkelte ingredienser. Kredit:Purdue Department of Food Science foto En nylig -
 Manganoxidmateriale kan hurtigt lagre og frigive lavgradig varme uden at nedbrydesVarme frigives fra manganoxidmaterialet, når vandmolekyler trænger ind i dets lagdelte struktur. Kredit:Norihiko L. Okamoto Forskere i Japan har fundet et almindeligt stof, der reversibelt og hurti
Manganoxidmateriale kan hurtigt lagre og frigive lavgradig varme uden at nedbrydesVarme frigives fra manganoxidmaterialet, når vandmolekyler trænger ind i dets lagdelte struktur. Kredit:Norihiko L. Okamoto Forskere i Japan har fundet et almindeligt stof, der reversibelt og hurti -
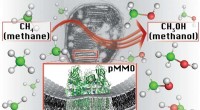 Metanforbrugende bakterier kan være fremtiden for brændstofDet primære metaboliske enzym i metanotrofe bakterier, partikelformig methanmonooxygenase (pMMO), katalyserer metan-til-methanol-omdannelsen på et sted med en kobberion. Kredit:Northwestern University
Metanforbrugende bakterier kan være fremtiden for brændstofDet primære metaboliske enzym i metanotrofe bakterier, partikelformig methanmonooxygenase (pMMO), katalyserer metan-til-methanol-omdannelsen på et sted med en kobberion. Kredit:Northwestern University
- Informationsmotoren fungerer med næsten perfekt effektivitet
- Ultimativ præcisionsgrænse for multi-parameter kvantemagnetometri
- Fordele og ulemper ved Phytomining
- Forskere opdager, hvordan og hvor brysttumorceller bliver i dvale, hvad der får dem til at metastas…
- ESA'er næste satellit drevet af butan
- Fornyet EPA-websted viser øgede risici for klimaændringer


