Hvad er karakteren af en vandig opløsning borax?
1. Grundlæggende :Borax er et moderat basisk salt. Når det er opløst i vand, gennemgår det hydrolyse, hvilket resulterer i frigivelse af hydroxidioner (OH-) og dannelse af borsyre (H3BO3). Denne grundlæggende karakter af borax kan tilskrives tilstedeværelsen af tetraborationer (B4O7^2-), som kan reagere med vand for at producere hydroxidioner.
2. Bufferkapacitet :Borax fungerer som en buffer i vandige opløsninger. Det kan hjælpe med at opretholde en relativt konstant pH inden for et bestemt område ved at reagere med enten syrer eller baser tilsat til opløsningen. Borationerne (B4O7^2-) og borsyre (H3BO3), der er til stede i opløsningen, deltager i bufferreaktioner for at minimere signifikante pH-ændringer.
3. Kompleks dannelse :Borax har evnen til at danne komplekse ioner med forskellige metalioner. I vandige opløsninger kan det reagere med metalioner og danne stabile komplekser, som kan ændre metalionernes kemiske adfærd og egenskaber. For eksempel er borax almindeligvis brugt til at danne komplekser med overgangsmetalioner, såsom kobber og nikkel, og finder anvendelser inden for galvanisering, metallurgi og analytisk kemi.
4. Opløselighed :Borax er moderat opløseligt i vand. Ved stuetemperatur (25°C) kan cirka 5,3 gram borax opløses i 100 gram vand. Dets opløselighed øges med stigende temperatur, hvilket muliggør fremstilling af mere koncentrerede opløsninger.
5. Vandblødgørende egenskaber :Borax har vandblødgørende egenskaber, hvilket gør den anvendelig i vaskemidler og rengøringsmidler. Det sekvestrerer calcium- og magnesiumioner, som almindeligvis er ansvarlige for vandhårdheden, hvilket forhindrer dem i at danne uopløselige bundfald og forårsager kalkopbygning i rør, apparater og VVS-armaturer.
Samlet set udviser en vandig opløsning af borax basicitet, bufferkapacitet, kompleksdannelse, opløselighed og vandblødgørende egenskaber, hvilket gør den værdifuld i forskellige industrielle, husholdnings- og laboratorieapplikationer.
 Varme artikler
Varme artikler
-
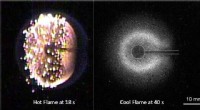 Seje flammer antændte i rummetVarme flammer (venstre) viger for kølige flammer (højre). Kredit:University of Maryland En opdagelse er blevet gjort i Jordens kredsløb - konstante sfæriske kølige diffusionsflammer. Målinger i di
Seje flammer antændte i rummetVarme flammer (venstre) viger for kølige flammer (højre). Kredit:University of Maryland En opdagelse er blevet gjort i Jordens kredsløb - konstante sfæriske kølige diffusionsflammer. Målinger i di -
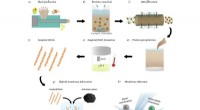 Dekontaminering af tungmetalvand ved hjælp af protein fra planteaffaldSkematisk over procesflow fra plantefrø til den amyloidbaserede filtreringsmembran. a) Fremstilling af solsikke- og jordnøddemel ved skruepresning af frø. b) Vandig proteinekstraktion af måltider (bru
Dekontaminering af tungmetalvand ved hjælp af protein fra planteaffaldSkematisk over procesflow fra plantefrø til den amyloidbaserede filtreringsmembran. a) Fremstilling af solsikke- og jordnøddemel ved skruepresning af frø. b) Vandig proteinekstraktion af måltider (bru -
 Kemi og datalogi går sammen om at anvende kunstig intelligens på kemiske reaktionerKredit:CC0 Public Domain I de seneste år, forskere har i stigende grad vendt sig mod datavidenskabelige teknikker for at hjælpe med problemløsning i organisk syntese. Forskere i laboratoriet til
Kemi og datalogi går sammen om at anvende kunstig intelligens på kemiske reaktionerKredit:CC0 Public Domain I de seneste år, forskere har i stigende grad vendt sig mod datavidenskabelige teknikker for at hjælpe med problemløsning i organisk syntese. Forskere i laboratoriet til -
 Plastikspisende enzymcocktail indvarsler nyt håb for plastikaffaldKredit:Aaron McGeehan Forskerne, der omkonstruerede det plastikspisende enzym PETase, har nu skabt et enzym cocktail, som kan fordøje plastik op til seks gange hurtigere. Et andet enzym, fundet i
Plastikspisende enzymcocktail indvarsler nyt håb for plastikaffaldKredit:Aaron McGeehan Forskerne, der omkonstruerede det plastikspisende enzym PETase, har nu skabt et enzym cocktail, som kan fordøje plastik op til seks gange hurtigere. Et andet enzym, fundet i


