Hvorfor er h2so4 mere tyktflydende?
Hydrogenbinding er den stærkeste form for intermolekylær kraft. Det opstår, når et brintatom er bundet til et meget elektronegativt atom, såsom oxygen eller nitrogen. Det elektronegative atom tiltrækker elektronerne i hydrogenbindingen, hvilket skaber en delvis positiv ladning på hydrogenatomet. Denne delvise positive ladning kan derefter tiltrække den delvise negative ladning på et andet elektronegativt atom og danne en hydrogenbinding. Hydrogenbinding er ansvarlig for vandets høje kogepunkt og svovlsyrens viskositet.
Svovlsyre har en højere viskositet end vand, fordi den har flere hydrogenbindinger pr. molekyle. Hvert svovlsyremolekyle har to brintatomer, der kan danne brintbindinger, mens hvert vandmolekyle kun har ét. Jo flere brintbindinger der er mellem molekyler, jo stærkere er de intermolekylære kræfter og jo højere viskositet.
Ion-dipol-interaktioner
Ion-dipol-interaktioner er en anden type intermolekylær kraft, der kan bidrage til svovlsyrens viskositet. Ion-dipol-interaktioner opstår, når en ion (et ladet atom eller molekyle) interagerer med et polært molekyle (et molekyle med en delvis positiv ladning og en delvis negativ ladning). Ionen tiltrækkes af den delvise negative ladning på det polære molekyle, og det polære molekyle tiltrækkes af den delvise positive ladning på ionen. Ion-dipol-interaktioner er svagere end hydrogenbindinger, men de kan stadig bidrage til svovlsyrens viskositet.
Van der Waals styrker
Van der Waals-kræfter er den svageste type intermolekylære kraft. De forekommer mellem alle molekyler, uanset deres polaritet eller ladning. Van der Waals kræfter er forårsaget af tiltrækningen mellem elektronerne i et molekyle og kernerne i et andet molekyle. Van der Waals kræfter er meget svage, men de kan stadig bidrage til svovlsyrens viskositet.
Kombinationen af hydrogenbinding, ion-dipol-interaktioner og Van der Waals-kræfter giver svovlsyre dens høje viskositet.
Sidste artikelHvilken tilstand er lithium ved 100 grader Celsius?
Næste artikelEr det kemisk eller fysisk reaktion at vende en øre guld?
 Varme artikler
Varme artikler
-
 Organotinforgiftning kan forårsage fedme, siger lægerRUDN -læger fandt ud af, at eksponering for organotiner kan forårsage metabolisk forstyrrelse og derfor føre til fedme Kredit:Natalia Deryugina RUDN -læger rapporterer, at udsættelse for organiske
Organotinforgiftning kan forårsage fedme, siger lægerRUDN -læger fandt ud af, at eksponering for organotiner kan forårsage metabolisk forstyrrelse og derfor føre til fedme Kredit:Natalia Deryugina RUDN -læger rapporterer, at udsættelse for organiske -
 En billig organisk dampgenerator til at rense vandVarmen fra solen fordamper vandet, mens salt og andre materialer forbliver tilbage. Kredit:Thor Balkhed Det er blevet anslået, at en fjerdedel af verdens børn i 2040 vil bo i regioner, hvor der ma
En billig organisk dampgenerator til at rense vandVarmen fra solen fordamper vandet, mens salt og andre materialer forbliver tilbage. Kredit:Thor Balkhed Det er blevet anslået, at en fjerdedel af verdens børn i 2040 vil bo i regioner, hvor der ma -
 Nye algoritmer vist at accelerere biofarmaceutisk procesKredit:Rensselaer Polytekniske Institut Biofarmaceutiske midler er nødvendige, livreddende værktøjer. Men processen for at lave dem er tidskrævende og dyr, især når det kommer til rensningsprocess
Nye algoritmer vist at accelerere biofarmaceutisk procesKredit:Rensselaer Polytekniske Institut Biofarmaceutiske midler er nødvendige, livreddende værktøjer. Men processen for at lave dem er tidskrævende og dyr, især når det kommer til rensningsprocess -
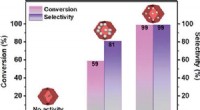 Et katalytisk system af uædle metaller til højeffektiv hydrogenering af nitroarenerKatalytisk ydeevne af katalysatorer med forskellige Zn/Co-forhold. Kredit:TIAN Hao En forskergruppe ledet af prof. LIU Jian fra Dalian Institute of Chemical Physics (DICP) ved det kinesiske videns
Et katalytisk system af uædle metaller til højeffektiv hydrogenering af nitroarenerKatalytisk ydeevne af katalysatorer med forskellige Zn/Co-forhold. Kredit:TIAN Hao En forskergruppe ledet af prof. LIU Jian fra Dalian Institute of Chemical Physics (DICP) ved det kinesiske videns
- Den gode, dårlige og ukendte Apples nye tjenester
- Californien sigter mod at blive kulstoffri i 2045 – er det muligt?
- Forskere opdager polære Bloch-punkter i anstrengte ferroelektriske film
- Binaural Beats:Beroliger denne auditive illusion virkelig din hjerne?
- Hvad gør protisterne unikke?
- Nye eksplosive materialer til at bringe ugiftig ammunition


