Hvad er en egenskab ved alkaliske metaller?
Alkaliske metaller er de mest reaktive af alle metaller. De reagerer kraftigt med vand for at producere brintgas og et metalhydroxid. For eksempel, når natriummetal falder i vand, reagerer det og danner natriumhydroxid og brintgas:
$$2Na(s) + 2H_2O(l) → 2NaOH(aq) + H_2(g)$$
Denne reaktion er så kraftig, at den kan få vandet til at koge og sprøjte.
Den høje reaktivitet af alkalimetaller skyldes deres lave ioniseringsenergi. Det betyder, at det er let for disse metaller at miste elektroner og danne positive ioner. Når et alkalimetal reagerer med vand, mister metalatomerne elektroner til vandmolekylerne, som bliver til hydroxidioner. Brintatomerne i vandmolekylerne får elektroner og bliver til brintgas.
Den høje reaktivitet af alkalimetaller gør dem også meget farlige. Disse metaller kan reagere eksplosivt med luft og andre stoffer, så de skal håndteres med forsigtighed.
 Varme artikler
Varme artikler
-
 Kunne vi genbruge plastikposer til fremtidens stoffer?MIT ingeniører har udviklet selvkølende stoffer fra polyethylen, almindeligvis brugt i plastikposer. De vurderer, at det nye stof kan være mere bæredygtigt end bomuld og andre almindelige tekstiler. K
Kunne vi genbruge plastikposer til fremtidens stoffer?MIT ingeniører har udviklet selvkølende stoffer fra polyethylen, almindeligvis brugt i plastikposer. De vurderer, at det nye stof kan være mere bæredygtigt end bomuld og andre almindelige tekstiler. K -
 Forskere foreslår, at man anvender metanoverflader af guld til at bestemme stoffets molekylære sam…Guldpartikler Kredit:Dmitry Bayer En ny metode vil gøre det muligt at skabe kompakte enheder, der nøjagtigt bestemmer den molekylære sammensætning af en væske eller gas, og hjælpe med at identific
Forskere foreslår, at man anvender metanoverflader af guld til at bestemme stoffets molekylære sam…Guldpartikler Kredit:Dmitry Bayer En ny metode vil gøre det muligt at skabe kompakte enheder, der nøjagtigt bestemmer den molekylære sammensætning af en væske eller gas, og hjælpe med at identific -
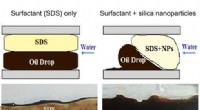 Nye materialer med vigtige anvendelser i forbedret oliegenvindingForskelle i bevægelsen af olie gennem mikrokanalerne ved tilsætning af overfladeaktivt stof i nærvær af silicananopartikler sammenlignet med det overfladeaktive middel alene, hvilket viser, hvordan
Nye materialer med vigtige anvendelser i forbedret oliegenvindingForskelle i bevægelsen af olie gennem mikrokanalerne ved tilsætning af overfladeaktivt stof i nærvær af silicananopartikler sammenlignet med det overfladeaktive middel alene, hvilket viser, hvordan -
 Nye lysdrevne katalysatorer kan hjælpe med fremstillingenMIT-kemikere har designet en ny type fotoredox-katalysator, der kan gøre det nemmere at inkorporere lysdrevne reaktioner i kontinuerlige produktionsprocesser. Polymerkatalysatorerne kunne bruges til a
Nye lysdrevne katalysatorer kan hjælpe med fremstillingenMIT-kemikere har designet en ny type fotoredox-katalysator, der kan gøre det nemmere at inkorporere lysdrevne reaktioner i kontinuerlige produktionsprocesser. Polymerkatalysatorerne kunne bruges til a
- NASA konstaterer, at vindskydning påvirker orkanen Maria, efterhånden som dens øje klarer sig
- Træer og grønne tage kan være med til at reducere den urbane varmeø-effekt, finder en ny undersø…
- Sådan forudsiger forskere den næste orkansæson
- Bakterielle enzymer kapret til at skabe komplekse molekyler, der normalt fremstilles af planter
- Kina overvejer en atomdrevet mission til Neptun
- Den amerikanske senator Schumer opfordrer til undersøgelse af FaceApp


