Hvorfor danner grundstoffer ioniske og/eller kovalente bindinger?
1. Ioniske bindinger:
Ionbindinger dannes, når der er en signifikant forskel i elektronegativitet mellem atomer, hvilket fører til overførsel af elektroner fra et atom til et andet. Dette resulterer i dannelsen af positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Ionbindinger dannes typisk mellem metaller og ikke-metaller. For eksempel:
- Natrium (Na) og Klor (Cl) danner en ionbinding for at danne NaCl (natriumchlorid), hvor Na mister en elektron til Cl, hvilket resulterer i Na+ og Cl- ioner.
2. Kovalente bindinger:
Kovalente bindinger dannes, når atomer har lignende elektronegativiteter og deler elektroner i stedet for at overføre dem fuldstændigt. Denne type binding opstår, når forskellen i elektronegativitet mellem atomer er relativt lille. Kovalente bindinger findes normalt mellem ikke-metaller eller mellem metalloider og ikke-metaller. For eksempel:
- Hydrogen (H) og Hydrogen (H) danner en kovalent binding for at skabe H2 (dihydrogen), hvor hvert atom deler den ene elektron med den anden.
3. Polære kovalente bindinger:
Polære kovalente bindinger opstår, når elektronegativitetsforskellen mellem atomer ikke er signifikant nok til fuldstændig elektronoverførsel, men det er stadig tilstrækkeligt til at skabe en lille ubalance i elektrondeling. Dette resulterer i de partielle ladninger på atomerne, hvor det mere elektronegative atom får en lille negativ ladning og det mindre elektronegative atom har en lille positiv ladning. For eksempel:
- Hydrogen (H) og Klor (Cl) danner en polær kovalent binding i HCl (hydrogenchlorid), hvor Cl udøver en stærkere tiltrækning af elektroner, hvilket skaber en delvis negativ ladning på Cl og en delvis positiv ladning på H.
Sammenfattende danner elementer ioniske og kovalente bindinger baseret på deres elektronegativiteter. Ionbindinger involverer elektronoverførsel og resulterer i dannelsen af ioner, mens kovalente bindinger involverer elektrondeling mellem atomer. Polære kovalente bindinger opstår, når der er en delvis deling af elektroner på grund af en lille forskel i elektronegativitet.
Sidste artikelHvorfor udvindes aluminium fra malm ved hjælp af en højovn?
Næste artikelHvad er menneskeskabt, der har ilt i sig?
 Varme artikler
Varme artikler
-
 Video:Hvad er evige kemikalier, og holder de evigt?For altid er kemikalier kendt for at være vand-, varme- og oliebestandig, hvilket gør dem nyttige i alt fra regnjakker til brandslukningsskum. Men den kemi, der gør dem så nyttige, får dem også til at
Video:Hvad er evige kemikalier, og holder de evigt?For altid er kemikalier kendt for at være vand-, varme- og oliebestandig, hvilket gør dem nyttige i alt fra regnjakker til brandslukningsskum. Men den kemi, der gør dem så nyttige, får dem også til at -
 Hydrogenering uden brint:Effektiv katalyse i en stabil emulsionsgelKredit:Transmission Electron Microscope (TEM) billeder af Dele Peter Fapojuwo, Universitetet i Johannesburg. Grafisk design af Therese van Wyk, Universitetet i Johannesburg. UJ-forskere tager et n
Hydrogenering uden brint:Effektiv katalyse i en stabil emulsionsgelKredit:Transmission Electron Microscope (TEM) billeder af Dele Peter Fapojuwo, Universitetet i Johannesburg. Grafisk design af Therese van Wyk, Universitetet i Johannesburg. UJ-forskere tager et n -
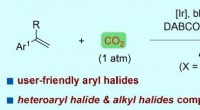 Synligt lys-drevet arylcarboxylering af styrener med kuldioxid og arylhalogeniderFigur:Synligt lys-drevet arylcarboxylering af styrener med CO2 og arylhalogenider. Kredit:Prof. LIs gruppe Brugen af kuldioxid (CO 2 ), som er en ideel one-carbon (C1) byggesten og er bæredygt
Synligt lys-drevet arylcarboxylering af styrener med kuldioxid og arylhalogeniderFigur:Synligt lys-drevet arylcarboxylering af styrener med CO2 og arylhalogenider. Kredit:Prof. LIs gruppe Brugen af kuldioxid (CO 2 ), som er en ideel one-carbon (C1) byggesten og er bæredygt -
 Smart materiale muliggør nye applikationer inden for autonom kørsel og robotikSmart materiale muliggør nye applikationer inden for autonom kørsel, robotik, og sensorteknologi. Kredit:University of Luxembourg Forskning ledet af forskere fra University of Luxembourg har vist
Smart materiale muliggør nye applikationer inden for autonom kørsel og robotikSmart materiale muliggør nye applikationer inden for autonom kørsel, robotik, og sensorteknologi. Kredit:University of Luxembourg Forskning ledet af forskere fra University of Luxembourg har vist
- Kunne klassisk teori være lige så mærkelig kvanteteori?
- Hvis du rammer vandet fra en stor højde, vil virkningen dræbe dig?
- Elastiske ledningsformede lithium-ion-batterier med høj elektrokemisk ydeevne
- Slangeskind inspirerer nye, friktionsreducerende materiale
- Kunstig neuron-enhed kunne skrumpe energiforbruget og størrelsen af neurale netværkshardware
- Det svarer til en ny kvantevæske?


