Forklar hvordan tiltrækninger mellem molekyler kan få vand til at have et højere kogepunkt end kuldioxid?
I tilfælde af vand er den intermolekylære kraft hydrogenbinding. Hydrogenbinding er en dipol-dipol-interaktion, der forekommer mellem et hydrogenatom, der er kovalent bundet til et stærkt elektronegativt atom (såsom oxygen, nitrogen eller fluor) og et andet elektronegativt atom. I vand er hydrogenatomerne kovalent bundet til oxygenatomerne, og oxygenatomerne er stærkt elektronegative, hvilket skaber en stærk hydrogenbinding mellem vandmolekyler. Disse brintbindinger skaber et netværk af interaktioner mellem vandmolekyler, der kræver mere energi for at bryde dem og omdanne vand til en damp, hvilket resulterer i et højere kogepunkt.
På den anden side er kuldioxidmolekyler upolære, hvilket betyder, at de ikke har et signifikant dipolmoment. Den intermolekylære kraft mellem kuldioxidmolekyler er London-spredningskræfter, som er svage van der Waals-kræfter, der opstår som følge af de midlertidige fluktuationer i elektronfordelingen. London-spredningskræfterne er meget svagere end hydrogenbindinger, så det kræver mindre energi at bryde dem og omdanne kuldioxid til en damp, hvilket resulterer i et lavere kogepunkt.
Derfor er den stærkere hydrogenbinding i vand sammenlignet med de svagere London-spredningskræfter i kuldioxid, hvad der får vand til at have et højere kogepunkt end kuldioxid.
 Varme artikler
Varme artikler
-
 Nye fund om den største naturlige svovlkilde i atmosfærenLaboratorieopsætning af gratis jet-eksperimentet på TROPOS i Leipzig, som muliggør undersøgelse af den tidlige fase af oxidationsreaktioner under atmosfæriske forhold uden at væggene påvirker reaktion
Nye fund om den største naturlige svovlkilde i atmosfærenLaboratorieopsætning af gratis jet-eksperimentet på TROPOS i Leipzig, som muliggør undersøgelse af den tidlige fase af oxidationsreaktioner under atmosfæriske forhold uden at væggene påvirker reaktion -
 Klart og effektivt lys uden sjældne metallerKredit:Mattias Lindh Moderne smartphone -skærme, samt mange andre effektive lyskilder, indeholde dyre og miljøproblematiske sjældne metaller. For en bæredygtig fremtid, ingeniører skal vende sig t
Klart og effektivt lys uden sjældne metallerKredit:Mattias Lindh Moderne smartphone -skærme, samt mange andre effektive lyskilder, indeholde dyre og miljøproblematiske sjældne metaller. For en bæredygtig fremtid, ingeniører skal vende sig t -
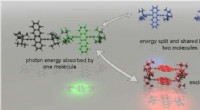 Vejen åbner for at minimere spild i solenergiopsamlingFotonenergiopdeling udføres direkte af to molekyler, ikke via en excimer-tilstand (i rødt). Singlet fissionsmaterialer skal undgå excimerdannelse for at nå det fulde potentiale til at forbedre fotovol
Vejen åbner for at minimere spild i solenergiopsamlingFotonenergiopdeling udføres direkte af to molekyler, ikke via en excimer-tilstand (i rødt). Singlet fissionsmaterialer skal undgå excimerdannelse for at nå det fulde potentiale til at forbedre fotovol -
 Grønt alternativ til PET kunne være endnu grønnereProfessor i polymerkemi Katja Loos. Kredit:Universitetet i Groningen En af de mest succesrige plasttyper er polyethylenterephthalat (PET), det materiale, vi bruger til at lave flasker og fibre til
Grønt alternativ til PET kunne være endnu grønnereProfessor i polymerkemi Katja Loos. Kredit:Universitetet i Groningen En af de mest succesrige plasttyper er polyethylenterephthalat (PET), det materiale, vi bruger til at lave flasker og fibre til
- Fermi ser gammastråler fra skjulte soludbrud
- Realisering af højtydende magnetiske sensorer på grund af magnetiske hvirvelstrukturer
- Rh-ensemble-katalysator til effektiv behandling af biludstødning
- Sollys, der filtrerer gennem Venus-skyer, kunne understøtte jordlignende fotosyntese i skylagene
- Hvordan man bliver kvitt mus om vinteren
- Sådan bygger du et Atom Science Project


