Hvordan kan du vise effekten af tryk på opløseligheden kuldioxidgas i vand?
Materialer:
- To klare glasflasker med låg
- Koldt postevand
- Kuldioxidgascylinder eller en kulsyreholdig drik (f.eks. sodavand eller mousserende vand)
- Trykmåler (valgfrit)
Procedure:
1. Fyld begge glasflasker med lige meget koldt postevand.
2. Luk en af flaskerne tæt med dens hætte. Dette vil tjene som kontrolflaske.
3. Tilslut kuldioxidgascylinderen, eller brug en kulsyreholdig drik til at indføre kuldioxidgas i den anden flaske. Tilsæt gas, indtil flasken er sat under tryk. Hvis det er tilgængeligt, overvåg trykket inde i flasken ved hjælp af trykmåleren.
4. Luk flasken med kuldioxidgas tæt med hætten.
5. Stil begge flasker til side ved stuetemperatur i et par minutter, så gassen kan opløses i vandet.
Observationer:
Åbn begge flasker og vær opmærksom på følgende:
1. I kontrolflasken bør der være lidt eller ingen kuldioxidgas til stede, da den er i ligevægt med atmosfæren.
2. I flasken, der var sat under tryk med kuldioxidgas, skal du observere tilstedeværelsen af bobler eller brus, hvilket indikerer den opløste kuldioxidgas.
Forklaring:
Henrys lov siger, at opløseligheden af en gas i en væske er direkte proportional med partialtrykket af den gas over væsken. Med andre ord, når trykket af kuldioxidgas stiger, stiger dens opløselighed i vand.
Når du trykker flasken med kuldioxidgas, øger du partialtrykket af kuldioxid over vandet. Dette driver flere kuldioxidmolekyler ud i vandet, hvilket fører til en stigning i opløseligheden af kuldioxid i vandet.
Ved at sammenligne kontrolflasken (uden ekstra tryk) med flasken under tryk kan man tydeligt observere trykkets effekt på kuldioxidgas opløselighed i vand.
 Varme artikler
Varme artikler
-
 Proteinmodificeret fast elektrolyt-interfasedannelse og udvikling i Li-metalbatterierVed den forhøjede temperatur efter proteinholdig elektrolytfyldning danner proteinet en funktionel gruppe-rig SEI på Li-anode, der opbygger en jævn Li+ aflejring under cykling. Kredit:Journal of Energ
Proteinmodificeret fast elektrolyt-interfasedannelse og udvikling i Li-metalbatterierVed den forhøjede temperatur efter proteinholdig elektrolytfyldning danner proteinet en funktionel gruppe-rig SEI på Li-anode, der opbygger en jævn Li+ aflejring under cykling. Kredit:Journal of Energ -
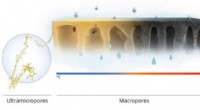 Brændende membraner til molekylær sigtningKredit:King Abdullah University of Science and Technology En robust nanofiltreringsmembran, der fungerer som en yderst effektiv molekylsigte, kan undgå mange af problemerne med nuværende polymermem
Brændende membraner til molekylær sigtningKredit:King Abdullah University of Science and Technology En robust nanofiltreringsmembran, der fungerer som en yderst effektiv molekylsigte, kan undgå mange af problemerne med nuværende polymermem -
 Miniaturedråber kunne løse en gåde om livets oprindelseKredit:George Hodan/public domain Det er en af biokemiens store ironier:livet på Jorden kunne ikke være begyndt uden vand; alligevel forhindrer vand nogle kemiske reaktioner, der er nødvendige f
Miniaturedråber kunne løse en gåde om livets oprindelseKredit:George Hodan/public domain Det er en af biokemiens store ironier:livet på Jorden kunne ikke være begyndt uden vand; alligevel forhindrer vand nogle kemiske reaktioner, der er nødvendige f -
 Forskere finder, at cuttlebones mikrostruktur sidder på et sødt stedPostdoc-forsker Zian Jia undersøger en 3D-printet model af cuttlebones mikrostruktur. Kredit:Peter Means for Virginia Tech. Ling Li har en lektion på et af sine maskiningeniørkurser om, hvordan sk
Forskere finder, at cuttlebones mikrostruktur sidder på et sødt stedPostdoc-forsker Zian Jia undersøger en 3D-printet model af cuttlebones mikrostruktur. Kredit:Peter Means for Virginia Tech. Ling Li har en lektion på et af sine maskiningeniørkurser om, hvordan sk
- Spintronics:Forbedring af elektronik med finere spinkontrol
- Ligner den menneskelige hjerne universet?
- NASA fanger Tropical Cyclone Titli på vej mod landgang i Indien
- Forskere udvikler trådløst, ultratynde og batterifrie belastningssensorer, der er 10 gange mere fø…
- At male kaffe med et stænk vand reducerer statisk elektricitet og gør mere konsistent og intens es…
- Hvor vand er begrænset, bestemmer forskerne, hvor meget nok


