Hvis 25,0 ml 1,48m h2so4 kan neutraliseres med 27,29 koh, hvad er molariteten koh?
H2SO4 + 2KOH -> K2SO4 + 2H2O
Fra den afbalancerede kemiske ligning kan vi se, at 1 mol H2SO4 reagerer med 2 mol KOH. Derfor er antallet af mol KOH, der kræves for at neutralisere 25,0 mL 1,48 M H2SO4:
Mol H2SO4 =(25,0 ml / 1000 ml/L) * 1,48 M =0,037 mol H2SO4
Mol KOH påkrævet =2 * 0,037 mol H2SO4 =0,074 mol KOH
Molariteten af KOH-opløsningen kan beregnes ved hjælp af formlen:
Molaritet =Mol opløst stof / Volumen af opløsning i liter
Volumen af anvendt KOH-opløsning =27,29 ml =0,02729 L
Molaritet af KOH =0,074 mol KOH / 0,02729 L =2,71 M
Derfor er molariteten af KOH-opløsningen 2,71 M.
 Varme artikler
Varme artikler
-
 Forskere opdager, at traditionelle væskestrømobservationer kan gå glip af det store billedeEn tidsmæssig reaktion opstod under væskestrømmen indikerede en grundlæggende strukturændring i væskerne. Kredit:Figur tilpasset med tilladelse fra forsiden af J. Phys. Chem. B 2019, 123, 21, 4587-4
Forskere opdager, at traditionelle væskestrømobservationer kan gå glip af det store billedeEn tidsmæssig reaktion opstod under væskestrømmen indikerede en grundlæggende strukturændring i væskerne. Kredit:Figur tilpasset med tilladelse fra forsiden af J. Phys. Chem. B 2019, 123, 21, 4587-4 -
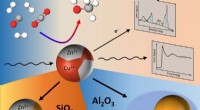 Zinkoxid:Nøglekomponent til methanolsyntesereaktionen over kobberkatalysatorerBimetalliske kobber-zink nanopartikler omdanner CO, CO2 og H2 til methanol. Kredit:© FHI/Kordus Den nuværende kommercielle produktion af methanol gennem hydrogenering af drivhusgassen CO 2 bygge
Zinkoxid:Nøglekomponent til methanolsyntesereaktionen over kobberkatalysatorerBimetalliske kobber-zink nanopartikler omdanner CO, CO2 og H2 til methanol. Kredit:© FHI/Kordus Den nuværende kommercielle produktion af methanol gennem hydrogenering af drivhusgassen CO 2 bygge -
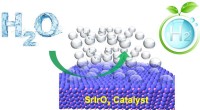 Forskere tager et vigtigt skridt mod renere, mere bæredygtig produktion af brintLedergrupperne fra Cornell University, Oregon State University og Argonne National Laboratory anvender et sæt avancerede karakteriseringsværktøjer til at studere atomstrukturens udvikling af en topmod
Forskere tager et vigtigt skridt mod renere, mere bæredygtig produktion af brintLedergrupperne fra Cornell University, Oregon State University og Argonne National Laboratory anvender et sæt avancerede karakteriseringsværktøjer til at studere atomstrukturens udvikling af en topmod -
 Test af de antibakterielle egenskaber af hydrofobe overflader på ISSKredit:European Space Agency Et rør ikke-direktiv gælder både for et Matisse-maleri og dette Matiss-eksperiment om bord på den internationale rumstation. Designet til at teste de antibakterielle
Test af de antibakterielle egenskaber af hydrofobe overflader på ISSKredit:European Space Agency Et rør ikke-direktiv gælder både for et Matisse-maleri og dette Matiss-eksperiment om bord på den internationale rumstation. Designet til at teste de antibakterielle
- Jordens fotosyntese hjælper med at afbøde miljøforurening
- Ordligning for afbrænding af fossile brændstoffer?
- Er CrO4 2- polær eller upolær?
- Top nitrogenforskere forestiller sig verden hinsides fossile brændstoffer
- Chandra genoptager videnskabelige operationer
- Ny underart af Begonia rapporteret fra Filippinerne


