hvad er ionbindinger?
Ionbindinger dannes typisk mellem et metal og et ikke-metal. Metalatomet mister elektroner til ikke-metalatomet, hvilket resulterer i dannelsen af en positivt ladet metalion og en negativt ladet ikke-metalion. Den elektrostatiske tiltrækning mellem disse modsat ladede ioner holder den ioniske forbindelse sammen.
Styrken af en ionbinding afhænger af ionernes ladninger og afstanden mellem dem. Jo større ladninger ionerne er og jo kortere afstanden er mellem dem, jo stærkere er ionbindingen.
Ionbindinger er ansvarlige for dannelsen af mange almindelige forbindelser, såsom natriumchlorid (NaCl), calciumfluorid (CaF2) og kaliumiodid (KI). Disse forbindelser er typisk hårde, skøre og har høje smeltepunkter. De er også gode ledere af elektricitet, når de er opløst i vand eller smeltede.
Her er en mere detaljeret forklaring på dannelsen af en ionbinding:
1. Et atom af et metal (såsom natrium) har en lav ioniseringsenergi. Det betyder, at det er let for atomet at miste elektroner.
2. Et atom af et ikke-metal (såsom klor) har en høj elektronegativitet. Det betyder, at det har en stærk tiltrækning af elektroner.
3. Når metal- og ikke-metalatomerne kommer i kontakt med hinanden, overfører metalatomet elektroner til ikke-metalatomet.
4. Dette resulterer i dannelsen af to modsat ladede ioner:en positivt ladet metalion og en negativt ladet ikke-metalion.
5. Den elektrostatiske tiltrækning mellem de modsat ladede ioner holder den ioniske forbindelse sammen.
Nogle eksempler på ionbindinger omfatter:
* Natriumchlorid (NaCl):Natriumatomer mister hver en elektron til kloratomer, hvilket resulterer i dannelsen af Na+ og Cl-ioner. Den elektrostatiske tiltrækning mellem Na+ og Cl- ionerne holder natriumchloridkrystallen sammen.
* Calciumfluorid (CaF2):Calciumatomer mister to elektroner hver til fluoratomer, hvilket resulterer i dannelsen af Ca2+ og F-ioner. Den elektrostatiske tiltrækning mellem Ca2+ og F-ionerne holder calciumfluoridkrystallen sammen.
* Kaliumiodid (KI):Kaliumatomer mister hver en elektron til jodatomer, hvilket resulterer i dannelsen af K+ og I-ioner. Den elektrostatiske tiltrækning mellem K+ og I-ionerne holder kaliumiodidkrystallen sammen.
Ionbindinger er en vigtig type kemisk binding, fordi de er ansvarlige for dannelsen af mange almindelige forbindelser. Disse forbindelser bruges i en bred vifte af applikationer, fra hverdagsprodukter til industrielle materialer.
Sidste artikelHvad er den kemiske ligning for jernsulfat med kobbertråd?
Næste artikeler postevand i et glas rene stoffer eller blandinger?
 Varme artikler
Varme artikler
-
 Vand, jordanalyseteknologi kan hjælpe med at forbedre oprydning og overvågning på forurenede Supe…Kredit:CC0 Public Domain Mindst 53 millioner amerikanere, inklusive omkring 18 procent af landets børn, bor mindre end tre miles fra en Superfund-side, ifølge Miljøstyrelsen. Kongressen oprettede
Vand, jordanalyseteknologi kan hjælpe med at forbedre oprydning og overvågning på forurenede Supe…Kredit:CC0 Public Domain Mindst 53 millioner amerikanere, inklusive omkring 18 procent af landets børn, bor mindre end tre miles fra en Superfund-side, ifølge Miljøstyrelsen. Kongressen oprettede -
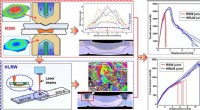 Forskere forbedrer de mekaniske egenskaber af aluminium/stålsamlingerGrafisk abstrakt. Kredit:Materials &Design (2022). DOI:10.1016/j.matdes.2022.111022 Forskere fra Shanghai Institute of Optics and Fine Mechanics (SIOM) fra det kinesiske videnskabsakademi (CAS) udf
Forskere forbedrer de mekaniske egenskaber af aluminium/stålsamlingerGrafisk abstrakt. Kredit:Materials &Design (2022). DOI:10.1016/j.matdes.2022.111022 Forskere fra Shanghai Institute of Optics and Fine Mechanics (SIOM) fra det kinesiske videnskabsakademi (CAS) udf -
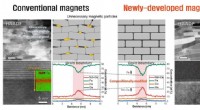 Udvikling af ny magnet, der reducerer brugen af sjældne jordarters grundstoffer med 30 %HAADF-STEM billeder og skematiske illustrationer af konventionelle magneter og nyudviklede magneter. Kredit:Korea Institute of Materials Science (KIMS) Et forskerhold ledet af Dr. Jung-Goo Lee og D
Udvikling af ny magnet, der reducerer brugen af sjældne jordarters grundstoffer med 30 %HAADF-STEM billeder og skematiske illustrationer af konventionelle magneter og nyudviklede magneter. Kredit:Korea Institute of Materials Science (KIMS) Et forskerhold ledet af Dr. Jung-Goo Lee og D -
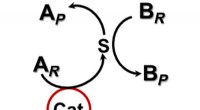 Accelererer kemiske reaktioner uden direkte kontakt med en katalysatorEt berøringsfrit katalytisk system. Kredit: Videnskabens fremskridt (2020). DOI:10.1126/sciadv.aax6637 Et forskerhold fra Northwestern University har afsløret en ny tilgang til at udføre kemiske
Accelererer kemiske reaktioner uden direkte kontakt med en katalysatorEt berøringsfrit katalytisk system. Kredit: Videnskabens fremskridt (2020). DOI:10.1126/sciadv.aax6637 Et forskerhold fra Northwestern University har afsløret en ny tilgang til at udføre kemiske
- Elektrodeform forbedrer neurostimulering for små mål
- 10 mest ødelæggende storme
- Ammoniak, der udledes fra gødede rismarker, ender for det meste ikke i luften
- Bøjning af en organisk halvleder kan øge elektrisk strøm
- Sådan fungerer økologisk mad
- Højkoncentrerede vandige elektrolytter kunne erstatte opløsningsmidler, der bruges i batterier


