Damptrykket af rent vand er 30 mm 10 glukoseopløsningen?
Molfraktionen af vand i en 10% glucoseopløsning kan beregnes som følger:
Molfraktion af vand =(mol vand) / (i alt mol opløsning)
Hvis vi antager, at vi har 100 gram opløsning, kan vi beregne mol vand og glukose som følger:
Mol vand =(100 - 10) / 18 =5 mol
Mol glucose =10 / 180 =0,0556 mol
Derfor er molfraktionen af vand:
Molfraktion af vand =5 mol / (5 + 0,0556) mol =0,988
Nu kan vi bruge Raoults lov til at beregne damptrykket af opløsningen:
Damptryk af opløsning =Molfraktion af vand × Damptryk af rent vand
Opløsningens damptryk =0,988 × 30 mm =29,64 mm
Derfor er damptrykket af en 10% glucoseopløsning 29,64 mm.
Sidste artikelHvad er eksempler på ikke-væske?
Næste artikelHvad er ligevægtsdamptryk?
 Varme artikler
Varme artikler
-
 Forskere tilfører bakterier med sølv for at forbedre energieffektiviteten i brændselscellerKunstnerens koncept om en mikrobiel brændselscelle med effektivitet boostet af sølv nanopartikler. Kredit:AKang, Sphere Studio. Copyright:Yu Huang og Xiangfeng Duan. AUCLA-ledede team af ingeniøre
Forskere tilfører bakterier med sølv for at forbedre energieffektiviteten i brændselscellerKunstnerens koncept om en mikrobiel brændselscelle med effektivitet boostet af sølv nanopartikler. Kredit:AKang, Sphere Studio. Copyright:Yu Huang og Xiangfeng Duan. AUCLA-ledede team af ingeniøre -
 Mystisk organisk skum øger effektiviteten af kemiske reaktioner, kan reducere kemisk affaldIllinois-forskere er en del af et multiinstitutionelt team, der fandt ud af, at opløsningsmidler spontant reagerer med metal-nanopartikler for at danne reaktive komplekser, der kan forbedre katalysato
Mystisk organisk skum øger effektiviteten af kemiske reaktioner, kan reducere kemisk affaldIllinois-forskere er en del af et multiinstitutionelt team, der fandt ud af, at opløsningsmidler spontant reagerer med metal-nanopartikler for at danne reaktive komplekser, der kan forbedre katalysato -
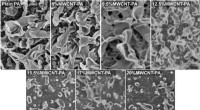 Forskere bruger kulstof nanorør-teknologi til at udvikle robuste vandafsaltningsmembranerSEM-billeder af MWCNT-PA (Multi-Walled Carbon Nanotube-Polyamide) nanokompositmembraner, for almindelig PA, og PA med 5, 9,5, 12,5, 15,5, 17 og 20 vægt% MWCNT, hvor de typiske laplignende strukturer o
Forskere bruger kulstof nanorør-teknologi til at udvikle robuste vandafsaltningsmembranerSEM-billeder af MWCNT-PA (Multi-Walled Carbon Nanotube-Polyamide) nanokompositmembraner, for almindelig PA, og PA med 5, 9,5, 12,5, 15,5, 17 og 20 vægt% MWCNT, hvor de typiske laplignende strukturer o -
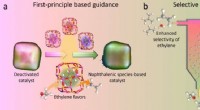 Forskere regenererer deaktiveret katalysator i methanol-til-olefin-processena. Første-principbaserede simuleringer giver kriterierne for stabilitet og funktionalitet af organiske mellemprodukter indespærret i nano-hulrum. b Selektiv omdannelse af koks til en specifik naphthal
Forskere regenererer deaktiveret katalysator i methanol-til-olefin-processena. Første-principbaserede simuleringer giver kriterierne for stabilitet og funktionalitet af organiske mellemprodukter indespærret i nano-hulrum. b Selektiv omdannelse af koks til en specifik naphthal
- Hvad beskriver bedst, hvad der sker i en kemisk reaktion?
- Er større virkelig bedre?
- Er ethen en monomer eller polymer?
- Byggesten bestående af sukkerfosfat og nitrogenbase?
- Undersøgelse viser, at udokumenteret immigration ikke øger voldelig kriminalitet
- Radioaktive grundstoffer i Cassiopeia A tyder på en neutrino-drevet eksplosion


