Hvordan adskiller egenskaberne af aluminium og kobber atomer fra deres ioner?
1. Elektronisk konfiguration:
- Aluminiumsatom:Aluminium har et atomnummer på 13, og dets neutrale atom indeholder 13 elektroner. Dens elektroniske konfiguration er [Ne] 3s^2 3p^1.
- Aluminiumion (Al^3+):Når aluminium mister tre valenselektroner, danner det en positivt ladet aluminiumion (Al^3+). Den elektroniske konfiguration af Al^3+ bliver [Ne].
- Kobberatom:Kobber har et atomnummer på 29, og dets neutrale atom indeholder 29 elektroner. Dens elektroniske konfiguration er [Ar] 3d^10 4s^1.
- Kobberion (Cu^2+):Ved tab af to valenselektroner danner kobber en positivt ladet kobberion (Cu^2+). Den elektroniske konfiguration af Cu^2+ bliver [Ar] 3d^9.
2.Opladning:
- Aluminiumion:Al^3+ har en +3 ladning på grund af tab af tre elektroner.
- Kobberion:Cu^2+ har en +2 ladning, fordi den mister to elektroner.
3. Størrelse:
- Aluminiumion:Når et aluminiumatom mister tre elektroner, falder dets atomradius betydeligt. Dette skyldes, at fjernelse af elektroner bringer den positivt ladede kerne tættere på de resterende elektroner.
- Kobberion:På samme måde er kobberioner (Cu^2+) mindre i størrelse sammenlignet med neutrale kobberatomer. Tabet af to elektroner får kobbers atomradius til at trække sig sammen.
4.Reaktivitet:
- Aluminiumion:Aluminiumioner (Al^3+) er mere reaktive end aluminiumatomer. Den høje positive ladning af Al^3+ gør det mere sandsynligt, at det tiltrækker og binder sig til negativt ladede ioner eller molekyler.
- Kobberion:Kobberioner (Cu^2+) er også mere reaktive end neutrale kobberatomer. På grund af den fyldte 3d elektron-subskal i Cu^2+ udviser den imidlertid mindre reaktivitet sammenlignet med Al^3+.
5. Oxidationstilstande:
- Aluminium Atom:Aluminium udviser typisk en +3 oxidationstilstand, som det ses i Al^3+ ioner.
- Kobberatom:Kobber kan udvise forskellige oxidationstilstande, herunder +1 (Cu+), +2 (Cu^2+) og endnu højere oxidationstilstande i visse forbindelser.
Disse forskelle i egenskaber mellem aluminium- og kobberatomer og deres ioner har væsentlig indflydelse på deres kemiske adfærd, reaktivitet og dannelsen af forbindelser.
Sidste artikelHvilke ioner består H20 af?
Næste artikelHvilken gas er et drivhus A nitrogen B svovldioxid C oxygen D kuldioxid?
 Varme artikler
Varme artikler
-
 Dekonstruktion af superfooden, der bestemmer honningbiernes hierarkiKredit:CC0 Public Domain Alle bilarver spiser royal gelé, når de er nye, men kun fremtidige dronninger fortsætter med at spise det. For at finde ud af hvorfor, forskere i Østrig ser nærmere på de
Dekonstruktion af superfooden, der bestemmer honningbiernes hierarkiKredit:CC0 Public Domain Alle bilarver spiser royal gelé, når de er nye, men kun fremtidige dronninger fortsætter med at spise det. For at finde ud af hvorfor, forskere i Østrig ser nærmere på de -
 Letvægtsperioden spiller en stor rolle i livet på JordenKredit:Panimoni/Shutterstock.com Selvom brint er letvægtsstoffet for de kemiske grundstoffer, det giver et rigtigt slag når det kommer til sin rolle i livet og dets potentiale som en løsning på no
Letvægtsperioden spiller en stor rolle i livet på JordenKredit:Panimoni/Shutterstock.com Selvom brint er letvægtsstoffet for de kemiske grundstoffer, det giver et rigtigt slag når det kommer til sin rolle i livet og dets potentiale som en løsning på no -
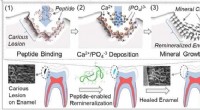 Peptidbaseret biogent tandprodukt kan helbrede hullerSkematisk illustration af peptidstyret biomimetisk tandreparationsteknologi. Kredit:ACS Publications Forskere ved University of Washington har designet et praktisk og naturligt produkt, der bruger
Peptidbaseret biogent tandprodukt kan helbrede hullerSkematisk illustration af peptidstyret biomimetisk tandreparationsteknologi. Kredit:ACS Publications Forskere ved University of Washington har designet et praktisk og naturligt produkt, der bruger -
 Forskere opfinder ny katalysator til omdannelse af kuldioxidDr Edwin S. Gnanakumar driver den katalytiske strøm. Kredit:HIMS/UvA Forskere fra University of Amsterdam (UvA) har opfundet en ny katalysator, der effektivt kan omdanne kuldioxid (CO2) til kulilt
Forskere opfinder ny katalysator til omdannelse af kuldioxidDr Edwin S. Gnanakumar driver den katalytiske strøm. Kredit:HIMS/UvA Forskere fra University of Amsterdam (UvA) har opfundet en ny katalysator, der effektivt kan omdanne kuldioxid (CO2) til kulilt
- Hvordan N2O drivhusgassen nedbrydes
- Forskere opdager, at traditionelle væskestrømobservationer kan gå glip af det store billede
- Group udvikler teknik til at forme pulser af intens infrarødt lys
- Hvad kan man forvente, når total solformørkelse passerer gennem Ohio
- Løsningen på et forvirrende fænomen kan åbne døren til forbedret koldsprøjteeffektivitet
- Laserbaseret prototype sonderer koldatoms dynamik


