Hvorfor er det sværere at fjerne en elektron fra magnesium end calcium?
I tilfælde af Magnesium og Calcium har Calcium en lavere ioniseringsenergi end magnesium. Det betyder, at det er lettere at fjerne en elektron fra Calcium, end det er fra magnesium.
Magnesium har 12 protoner i sin kerne, mens Calcium har 20 protoner. Det øgede antal protoner i Calcium skaber en stærkere tiltrækningskraft mellem kernen og elektronerne, hvilket gør det sværere at fjerne en elektron fra Calcium.
Derudover er elektronerne i Magnesium arrangeret i tre elektronskaller, mens elektronerne i Calcium er arrangeret i fire elektronskaller. Elektronen i den yderste skal af Calcium er længere væk fra kernen end elektronen i den yderste skal af magnesium. Denne øgede afstand reducerer tiltrækningskraften mellem kernen og den yderste elektron i Calcium, hvilket gør det lettere at fjerne.
Derfor er det på grund af den øgede kerneladning og den øgede afstand af den yderste elektron fra kernen lettere at fjerne en elektron fra Calcium end fra Magnesium.
 Varme artikler
Varme artikler
-
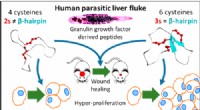 Et molekyle produceret af en thailandsk leverparasit kan være løsningen på de ikke-helende sårKredit:ACS Hver dag amputeres 12 australske diabetikere på grund af et sår, der ikke heler. Globalt set det er en hvert 30. sekund. Et molekyle produceret af en thailandsk leverparasit kan være l
Et molekyle produceret af en thailandsk leverparasit kan være løsningen på de ikke-helende sårKredit:ACS Hver dag amputeres 12 australske diabetikere på grund af et sår, der ikke heler. Globalt set det er en hvert 30. sekund. Et molekyle produceret af en thailandsk leverparasit kan være l -
 Bedre forståelse af principperne for siliciumætsning fører til forbedret overflademønsterVed hjælp af nøje udvalgte kombinationer af metaller, det er muligt at etse indviklede mønstre på en siliciumoverflade, som vist ovenfor. Kredit:Ref. 1 og licenseret under CC BY 4.0 © 2016 L. Kong et
Bedre forståelse af principperne for siliciumætsning fører til forbedret overflademønsterVed hjælp af nøje udvalgte kombinationer af metaller, det er muligt at etse indviklede mønstre på en siliciumoverflade, som vist ovenfor. Kredit:Ref. 1 og licenseret under CC BY 4.0 © 2016 L. Kong et -
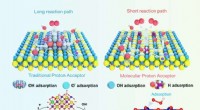 Designstrategi på molekylært niveau kan være nøglen til at øge kommerciel brintproduktionSammenligning mellem reaktionsmekanismerne i et hybridsystem med en konventionel heterostruktur og enkeltfasesystemet med protonacceptorer på molekylært niveau udviklet af forskerne. Kredit:Nanjing Un
Designstrategi på molekylært niveau kan være nøglen til at øge kommerciel brintproduktionSammenligning mellem reaktionsmekanismerne i et hybridsystem med en konventionel heterostruktur og enkeltfasesystemet med protonacceptorer på molekylært niveau udviklet af forskerne. Kredit:Nanjing Un -
 Forskere producerer højstyrkepuds udelukkende af affaldVed at bruge affaldsstoffer fra forskellige industrier har KTU -forskere støbt gipssten, som er to gange stærkere end normalt. Kredit:KTU Omkring 5 tons fosfogips produceres pr. Ton fosforsyreprod
Forskere producerer højstyrkepuds udelukkende af affaldVed at bruge affaldsstoffer fra forskellige industrier har KTU -forskere støbt gipssten, som er to gange stærkere end normalt. Kredit:KTU Omkring 5 tons fosfogips produceres pr. Ton fosforsyreprod
- UAE annoncerer pan-arabisk organ for rumprogram
- Ørkenpoplernes genetiske plan:Indsigt i tilpasnings- og overlevelsesmekanismer
- Wafer-skala mønstre af guld nanopartikel arrays muliggør forbedret biosensing
- Sådan laver du en øjenrørssprøjte
- Sådan testes Calciumhydroxid
- Forskellen mellem makroelementer og mikroelementer


