Hvilke intermolekylære kræfter er til stede i natriumchlorid?
Ionbinding er en type kemisk binding dannet af den elektrostatiske tiltrækning mellem modsat ladede ioner. I tilfælde af natriumchlorid tiltrækkes natriumionerne til chloridionerne og omvendt, hvilket resulterer i en stærk ionbinding.
Styrken af ionbindingen i natriumchlorid er påvirket af flere faktorer, herunder ladningen af ionerne, størrelsen af ionerne og gitterenergien. Gitterenergien er den energi, der kræves for at adskille alle ionerne i et mol af en ionforbindelse. Jo højere gitterenergi, jo stærkere ionbinding.
I natriumchlorid har natrium- og chloridionerne relativt høje ladninger (henholdsvis +1 og -1) og små størrelser. Dette resulterer i en stærk elektrostatisk tiltrækning mellem ionerne, hvilket afspejles i den høje gitterenergi af natriumchlorid (769 kJ/mol).
Derfor er de intermolekylære kræfter til stede i natriumchlorid stærke ionbindinger, som er ansvarlige for forbindelsens høje smeltepunkt, kogepunkt og opløselighed i polære opløsningsmidler.
Sidste artikelHvor mange svovlatomer er der i et gram svovl?
Næste artikelHvad er den førende teori om dannelse af fossile brændstoffer?
 Varme artikler
Varme artikler
-
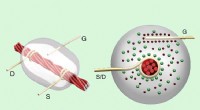 Ingeniører laver transistorer og elektroniske enheder udelukkende af trådTop- og tværsnitsbilleder af gevindbaseret transistor. Kilde (S) og afløbsledninger (D) er bundet til carbon nanorør belagt tråd, dyppet i en elektrolytisk gate gel. En gateledning er forbundet til ge
Ingeniører laver transistorer og elektroniske enheder udelukkende af trådTop- og tværsnitsbilleder af gevindbaseret transistor. Kilde (S) og afløbsledninger (D) er bundet til carbon nanorør belagt tråd, dyppet i en elektrolytisk gate gel. En gateledning er forbundet til ge -
 Spontan syntese af homogene polymernetværkFig. 1:Skematisk illustration for spontan syntese af et homogent termoresponsivt polymernetværk sammensat af polymerer med snæver molekylvægtfordeling. Kredit:Nagoya University Nagoya-forskere udv
Spontan syntese af homogene polymernetværkFig. 1:Skematisk illustration for spontan syntese af et homogent termoresponsivt polymernetværk sammensat af polymerer med snæver molekylvægtfordeling. Kredit:Nagoya University Nagoya-forskere udv -
 Hurtige og pålidelige tests for legionellabakterier i vandKredit:Giovanni Cancemi, Shutterstock En fuldautomatisk testanordning kan nu installeres på vandsteder, der er mistænkt for forurening med legionella-bakterier. Enheden lover mere pålidelige resul
Hurtige og pålidelige tests for legionellabakterier i vandKredit:Giovanni Cancemi, Shutterstock En fuldautomatisk testanordning kan nu installeres på vandsteder, der er mistænkt for forurening med legionella-bakterier. Enheden lover mere pålidelige resul -
 Nanokrystaller hjælper med at opdage methanol og andre alkoholerKredit:CC0 Public Domain Skoltech-forskere har udviklet meget følsomme sensorer baseret på koboltoxidnanoflager, som er i stand til at detektere forskellige alkoholer i luften. De nye sensorer kan
Nanokrystaller hjælper med at opdage methanol og andre alkoholerKredit:CC0 Public Domain Skoltech-forskere har udviklet meget følsomme sensorer baseret på koboltoxidnanoflager, som er i stand til at detektere forskellige alkoholer i luften. De nye sensorer kan
- Hvad er det udtryk, der bruges til at beskrive skyer med nedbør?
- Udvikling af uorganisk blyfri perovskite til bredbåndsemission
- Porøse polymerfilm med formhukommelse
- Fjenden indeni:Hvordan patogener spredes uigenkendt i kroppen
- Hvilke ting er lavet af rubidium?
- Forskere identificerer karakteristiske dybe infralydsbuller fra rumopsendelser


