Hvad er oxidationstilstanden for CI i HCIO3?
For at bestemme oxidationstilstanden af Cl i HClO3 skal vi overveje ladningerne af de andre atomer og den samlede ladning af molekylet. Her er den trinvise beregning:
1. Ilt (O) har typisk en oxidationstilstand på -2, og der er tre oxygenatomer i HClO3. Så det samlede bidrag fra ilt er 3 * (-2) =-6.
2. Brint (H) har en oxidationstilstand på +1. Da der er et hydrogenatom i HClO3, er dets bidrag +1.
3. Lad x være oxidationstilstanden for chlor (Cl) i HClO3.
4. Den samlede ladning af HClO3 er neutral, hvilket betyder, at summen af oxidationstilstandene for alle atomer i molekylet skal være nul.
Vi kan opstille ligningen:
x + (-6) + (+1) =0
Løsning for x:
x =+5
Derfor er oxidationstilstanden for chlor (Cl) i HClO3 +5.
Sidste artikelReagerer kuldioxid med jodopløsning?
Næste artikelTrinene i nitrogenkredsløbet?
 Varme artikler
Varme artikler
-
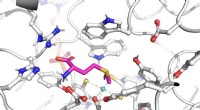 Små forskelle i aminosyrer kan føre til dramatisk forskellige enzymerKredit:University of Queensland Blot nogle få ændringer af et enzyms aminosyrer kan være nok til dramatisk at ændre dets funktion, gør det muligt for mikrober at leve i vildt forskellige miljøer.
Små forskelle i aminosyrer kan føre til dramatisk forskellige enzymerKredit:University of Queensland Blot nogle få ændringer af et enzyms aminosyrer kan være nok til dramatisk at ændre dets funktion, gør det muligt for mikrober at leve i vildt forskellige miljøer. -
 Når menneskelig ekspertise forbedrer maskinernes arbejdeGeorgia Tech Ph.D. Kandidat Lee Griffin placerer enkeltkrystalprøven på måletrinnet af det modificerede atomkraftmikroskop (dvs. piezoresponskraftmikroskop). Kredit:Rob Felt, Georgia Tech Maskinlæ
Når menneskelig ekspertise forbedrer maskinernes arbejdeGeorgia Tech Ph.D. Kandidat Lee Griffin placerer enkeltkrystalprøven på måletrinnet af det modificerede atomkraftmikroskop (dvs. piezoresponskraftmikroskop). Kredit:Rob Felt, Georgia Tech Maskinlæ -
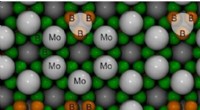 Forskere beregner krystalstruktur af superhårde molybdænboriderAtomarrangement i den højeste molybdænborid (MoB5-x) krystal Kredit:Dmitry V. Rybkovskiy, J. Phys. Chem. Lett. I deres søgen efter nye superhårde forbindelser, forskere har udført en forudsigelse
Forskere beregner krystalstruktur af superhårde molybdænboriderAtomarrangement i den højeste molybdænborid (MoB5-x) krystal Kredit:Dmitry V. Rybkovskiy, J. Phys. Chem. Lett. I deres søgen efter nye superhårde forbindelser, forskere har udført en forudsigelse -
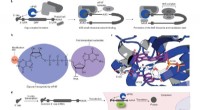 Biokemikere bruger nyt værktøj til at kontrollere mRNA ved hjælp af lys5′-hætten er et kendetegn for eukaryote mRNAer, der styrer translationsinitiering. a, Nøgletrin i oversættelsesinitiering. Den eukaryote translationsinitieringsfaktor eIF4E binder direkte til 5′-hætte
Biokemikere bruger nyt værktøj til at kontrollere mRNA ved hjælp af lys5′-hætten er et kendetegn for eukaryote mRNAer, der styrer translationsinitiering. a, Nøgletrin i oversættelsesinitiering. Den eukaryote translationsinitieringsfaktor eIF4E binder direkte til 5′-hætte


