Hvad er det frysepunkt for vand med 70000 ppm chlorid?
* "Chlorid" er ikke specifikt: Chlorid kunne henvise til en række chloridsalte (f.eks. Natriumchlorid, magnesiumchlorid, calciumchlorid). Hvert salt vil have en anden effekt på det frysepunkt for vand.
* koncentrationsenheder: 70.000 ppm (dele pr. Million) er en koncentrationsenhed, men den fortæller ikke direkte os molariteten (molen pr. Liter) af opløsningen, hvilket er nødvendigt for nøjagtigt at beregne depressionen for frysepunktet.
* frysningspunktdepression: Frysningspunktet for vand sænkes ved tilstedeværelsen af opløste opløste stoffer. Dette er kendt som frysepunktdepression. Mængden af depression afhænger af * molalitet * af opløsningen (mol opløst stof pr. Kg opløsningsmiddel).
For at bestemme frysepunktet har du brug for:
1. Identificer det specifikke chloridsalt: At vide, hvilket chloridsalt der er til stede, er vigtigt.
2. Konverter ppm til molalitet: Dette involverer konvertering af koncentrationen fra PPM til gram pr. Liter og derefter til mol pr. Kg vand.
3. Ligningen er:Δt =kf * m, hvor:
* ΔT er ændringen i frysepunktet
* KF er den frysepunkt depression konstant for vand (1,86 ° C/m)
* m er molaliteten af opløsningen.
Eksempel:
Lad os sige, at du har 70.000 ppm natriumchlorid (NaCl).
1. Konverter ppm til molalitet: Dette kræver nogle beregninger for at redegøre for den molære masse af NaCI og vandtætheden.
2. Beregn ΔT: Brug ligningen med frysepunktdepression med molaliteten af NaCl -opløsningen.
3. Træk fra det normale frysepunkt for vand (0 ° C): Dette giver dig det nye frysepunkt.
Vigtig note: Høje koncentrationer af chlorid -salte kan have en betydelig indflydelse på det frysepunkt for vand.
Sidste artikelGør kemiske reaktioner nye materialer kaldet reaktanterne?
Næste artikelHvilket element er et blødt hvidt materiale?
 Varme artikler
Varme artikler
-
 Udvikling af elektrodemateriale, der forbedrer effektiviteten af saltholdighedsgradientenergiVed anvendelse af omvendt elektrodialysesystem (a) Effekttæthed (b) Strømspændingskurve (c) Modstand (d) Princip for strømgenerering (e og f) Elektrokemisk reaktion og elektronoverførselsprincip ved e
Udvikling af elektrodemateriale, der forbedrer effektiviteten af saltholdighedsgradientenergiVed anvendelse af omvendt elektrodialysesystem (a) Effekttæthed (b) Strømspændingskurve (c) Modstand (d) Princip for strømgenerering (e og f) Elektrokemisk reaktion og elektronoverførselsprincip ved e -
 Video:Hvilken af disse svampe kan dræbe dig?Kredit:The American Chemical Society Der er titusindvis af svampearter derude, og nogle af dem kunne dræbe dig. I dag skal vi teste, hvor godt du kan adskille det helt sikre fra det farlige giftig
Video:Hvilken af disse svampe kan dræbe dig?Kredit:The American Chemical Society Der er titusindvis af svampearter derude, og nogle af dem kunne dræbe dig. I dag skal vi teste, hvor godt du kan adskille det helt sikre fra det farlige giftig -
 Forskere finder en ny anvendelse af affaldUBCO Postdoc-stipendiat Dr. Chinchu Cherian, sammen med lektor Dr. Sumi Siddiqua, undersøger et vejbygningsmateriale lavet delvist med genanvendt træaske. Kredit:UBCO Affaldsmaterialer fra papirma
Forskere finder en ny anvendelse af affaldUBCO Postdoc-stipendiat Dr. Chinchu Cherian, sammen med lektor Dr. Sumi Siddiqua, undersøger et vejbygningsmateriale lavet delvist med genanvendt træaske. Kredit:UBCO Affaldsmaterialer fra papirma -
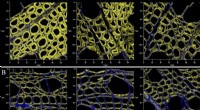 Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæringORNL -forskere brugte sofistikerede laserscanningsteknikker til at sammenligne nedbrydningen af fermenteret populær (B) sammenlignet med ugæret populær (A), som de kvantificerede, for første gang, k
Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæringORNL -forskere brugte sofistikerede laserscanningsteknikker til at sammenligne nedbrydningen af fermenteret populær (B) sammenlignet med ugæret populær (A), som de kvantificerede, for første gang, k
- Sådan beregnes en cylinderes volumen
- hvad er fordelen ved at have mange små celler i stedet for en stor celle?
- Små optiske elementer kan en dag erstatte traditionelle brydningslinser
- Hvordan vil du vide, om et sammensat bundfald efter substitutionsreaktion?
- Investeringsselskabet køber Gizmodo -websteder og The Onion
- Hvad sker der med en celle, hvis det ikke kopierer DNA-kromosomer, før det deler?


