Hvad er nogle hurtige kemiske reaktioner?
Ekstremt hurtige reaktioner (picosekunder til nanosekunder):
* Eksplosioner: Eksplosioner involverer ekstremt hurtige eksoterme reaktioner, der frigiver en stor mængde energi på kort tid, hvilket genererer en chokbølge.
* detonation af eksplosiver: TNT, dynamit og andre eksplosiver gennemgår hurtige nedbrydningsreaktioner, der producerer et stort volumen gas i et brøkdel af et sekund.
* forbrænding: Den hurtige reaktion mellem et brændstof og en oxidant (typisk ilt) til at producere varme og lys.
* forbrænding af brændstoffer: Træ, benzin og naturgas forbrænder hurtigt i nærvær af ilt og frigiver energi.
* fotokemiske reaktioner: Reaktioner initieret ved lysabsorption, der ofte forekommer i femtosekund (10^-15 sekunder) på picosekund (10^-12 sekunder) tidsskala.
* Fotosyntese: Den proces, hvorpå planter omdanner sollys til kemisk energi.
* Vision: Absorptionen af lys af rhodopsin i øjet initierer en række kemiske reaktioner, der fører til syn.
hurtige reaktioner (mikrosekunder til millisekunder):
* neutraliseringsreaktioner: Reaktioner mellem syrer og baser, som ofte fortsætter hurtigt i opløsning.
* titreringer: Bruges i kemi til at bestemme koncentrationen af en opløsning.
* enzymkatalyserede reaktioner: Reaktioner katalyseret af enzymer, hvilket kan øge hastigheden for en reaktion fra mange størrelsesordener.
* fordøjelse: Enzymer nedbryder fødevaremolekyler i mindre komponenter.
* Elektrokemiske reaktioner: Reaktioner, der forekommer ved grænsefladen mellem en elektrode og en elektrolyt.
* batterier: Elektrokemiske reaktioner i batterier omdanner kemisk energi til elektrisk energi.
Faktorer, der påvirker reaktionshastigheden:
* Temperatur: Højere temperaturer øger generelt reaktionshastighederne.
* Koncentration: Højere koncentrationer af reaktanter øger sandsynligheden for kollisioner, hvilket fører til hurtigere reaktioner.
* overfladeareal: Større overfladearealer giver mulighed for mere kontakt mellem reaktanter, stigende reaktionshastighed.
* katalysator: En katalysator fremskynder en reaktion uden at blive konsumeret i processen.
Bemærk: Dette er ikke en udtømmende liste, og hastigheden af en reaktion kan variere afhængigt af specifikke betingelser.
Sidste artikelHvad er de vigtigste ingredienser i saltvand?
Næste artikelHvad er tre typer kemiske reaktioner?
 Varme artikler
Varme artikler
-
 Med nyt værktøj til syntetisk biologi, forskere bruger bakterier til at fremkalde billederForskere fra University of Freiburg og ETH Zürich/Schweiz har udviklet et nyt optogenetisk værktøj og demonstreret dets effektivitet med en bakteriografi af Blade Runner (1982) filmplakaten. Kredit:Un
Med nyt værktøj til syntetisk biologi, forskere bruger bakterier til at fremkalde billederForskere fra University of Freiburg og ETH Zürich/Schweiz har udviklet et nyt optogenetisk værktøj og demonstreret dets effektivitet med en bakteriografi af Blade Runner (1982) filmplakaten. Kredit:Un -
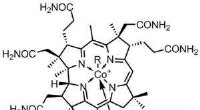 Forskere finder kroppens største cellereceptorKemisk struktur af vitamin B12. Kredit:Wikipedia En kæmpe paddehat, der sluger vitaminer og næringsstoffer i tarme og nyrer:Sådan ser én receptor ud, der optager B12-vitaminer i tyndtarmen. For fø
Forskere finder kroppens største cellereceptorKemisk struktur af vitamin B12. Kredit:Wikipedia En kæmpe paddehat, der sluger vitaminer og næringsstoffer i tarme og nyrer:Sådan ser én receptor ud, der optager B12-vitaminer i tyndtarmen. For fø -
 Inspireret af naturlige signaler i levende celler, forskere designer kunstig gasdetektorKemikere fra University of Tokyo har designet bittesmå nanokuber, der naturligt lyser blåt under UV-lys. Gløden er 3,9 gange stærkere, når kuberne er fyldt med brændbar gas. Nanokuberne er et første s
Inspireret af naturlige signaler i levende celler, forskere designer kunstig gasdetektorKemikere fra University of Tokyo har designet bittesmå nanokuber, der naturligt lyser blåt under UV-lys. Gløden er 3,9 gange stærkere, når kuberne er fyldt med brændbar gas. Nanokuberne er et første s -
 Forskere viser en bedre, mere miljøvenlig metode til at fremstille brintoverilteUniversity of Illinois forskere demonstrerer en mere effektiv og miljøvenlig metode til at producere hydrogenperoxid med palladium-guld nanopartikler, en katalysator, som de fandt, fungerer bedre, når
Forskere viser en bedre, mere miljøvenlig metode til at fremstille brintoverilteUniversity of Illinois forskere demonstrerer en mere effektiv og miljøvenlig metode til at producere hydrogenperoxid med palladium-guld nanopartikler, en katalysator, som de fandt, fungerer bedre, når
- Hvorfor er det lettere at fremstille stoffer, der bekæmper bakterier end vira?
- Distinkte pladegrænseflader fundet inden for kappeovergangszone
- Hvilke typer organismer ville være mest fordel af produkter, der er nedbrydning af produkter?
- Vask eller svøm for saltmyrer
- Hvor mange meter på 115 yards?
- Hvilken er den bedste hypotese til videnskabeligt spørgsmål Hvordan påvirker lysintensiteten af …


