Beregn det omtrentlige volumen på en 880 mol prøvegas ved -19,0c og tryk 2,75 atm?
1. Konverter enheder
* Temperatur: Konverter Celsius til Kelvin:
- K =° C + 273.15
- K =-19,0 ° C + 273,15 =254,15 K
* tryk: Ingen konvertering er nødvendigt, da atmosfærer er standardenheden for pres i den ideelle gaslov.
2. Den ideelle gaslov
Den ideelle gaslov er:
PV =NRT
hvor:
* P =pres (i atmosfærer)
* V =volumen (i liter)
* n =antal mol
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (i Kelvin)
3. Løs for volumen (v)
Omarranger ligningen for at løse for V:
V =(nrt) / p
4. Tilslut værdierne
V =(880 mol * 0,0821 L · ATM / Mol · K * 254,15 K) / 2,75 atm
5. Beregn lydstyrken
V ≈ 6537,6 L
Derfor er det omtrentlige volumen af 880 mol gasprøven ved -19,0 ° C og 2,75 atm ca. 6537,6 liter.
 Varme artikler
Varme artikler
-
 Chirale krabberKredit:Royal Society of Chemistry Sander Wezenberg, og ph.d. -studerende Thomas van Leeuwen og Kaja Sitkowska, fra University of Groningen i Holland, talte til os om deres arbejde inden for kirali
Chirale krabberKredit:Royal Society of Chemistry Sander Wezenberg, og ph.d. -studerende Thomas van Leeuwen og Kaja Sitkowska, fra University of Groningen i Holland, talte til os om deres arbejde inden for kirali -
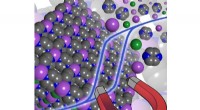 Mod næste generation af molekyle-baserede magneterBilledgengivelse af den molekylebaserede magnet og dens magnetiske egenskaber. Kredit:Rodolphe Clérac Magneter anvendes i en række teknologiske applikationer, inklusive satellitter, telefoner og k
Mod næste generation af molekyle-baserede magneterBilledgengivelse af den molekylebaserede magnet og dens magnetiske egenskaber. Kredit:Rodolphe Clérac Magneter anvendes i en række teknologiske applikationer, inklusive satellitter, telefoner og k -
 Forskere har opdaget nye forbindelser med herbicid potentiale fra havsvampOlesya Zhuravleva, Ph.D., Leder af Laboratoriet for biologisk aktive forbindelser, FEFU Naturvidenskabelige Skole. Kredit:FEFUs pressekontor Forskere ved Far Eastern Federal University (FEFU) og G
Forskere har opdaget nye forbindelser med herbicid potentiale fra havsvampOlesya Zhuravleva, Ph.D., Leder af Laboratoriet for biologisk aktive forbindelser, FEFU Naturvidenskabelige Skole. Kredit:FEFUs pressekontor Forskere ved Far Eastern Federal University (FEFU) og G -
 Molekylær kirurgi omformer levende væv med elektricitet, men uden indsnitEn ny ikke-invasiv proces kan ændre kurven for en hornhinde fra den, der ses i blåt i a) til den nye position, der ses med rød i b) for at løse synsproblemer. Kredit:Rachel Qu, Anna Stokolosa, Charlot
Molekylær kirurgi omformer levende væv med elektricitet, men uden indsnitEn ny ikke-invasiv proces kan ændre kurven for en hornhinde fra den, der ses i blåt i a) til den nye position, der ses med rød i b) for at løse synsproblemer. Kredit:Rachel Qu, Anna Stokolosa, Charlot


