Hvordan relavtive atommasser?
Hvad er relative atommasser?
* Relativ atommasse (AR) er massen af et atom af et element i forhold til 1/12 massen af et carbon-12 atom.
* Det er en enhedsløs mængde, hvilket betyder, at den ikke har en bestemt enhed som gram.
* Det er et vægtet gennemsnit af masserne af alle de naturligt forekommende isotoper af et element.
hvordan vi bestemmer relative atommasser:
1. isotoper:
* Isotoper er atomer med det samme element, der har det samme antal protoner, men forskellige antal neutroner. For eksempel er carbon-12, carbon-13 og carbon-14 alle isotoper af kulstof.
2. overflod:
* Hver isotop af et element forekommer i naturen med en bestemt overflod (procentdel).
3. massespektrometri:
* Massespektrometri er en teknik, der bruges til at bestemme den relative overflod og masser af isotoper.
4. Beregning:
* Den relative atommasse (AR) af et element beregnes ved at multiplicere massen af hver isotop med dens overflod og derefter opsummere resultaterne.
* Formlen er:
`` `
AR =(Mass af isotop 1 x Overflod af isotop 1) + (Mass af isotop 2 x Overflod af isotop 2) + ...
`` `
Eksempel:
* Chlor har to isotoper:klor-35 (overflod 75,77%) og klor-37 (overflod 24,23%).
* Den relative atommasse af klor beregnes som følger:
`` `
AR (Cl) =(35 x 0,7577) + (37 x 0,2423) =35,45
`` `
nøglepunkter at huske:
* Relative atommasser er ikke hele tal, fordi de repræsenterer vægtede gennemsnit af isotoper.
* Standarden for relative atommasser er carbon-12-atomet, der har en atommasse på 12.
Fortæl mig, hvis du har yderligere spørgsmål om relative atommasser eller isotoper!
Sidste artikelHvordan adskiller nuklear fusion sig grundlæggende fra fission?
Næste artikelHvad indeholder interstitiel væske?
 Varme artikler
Varme artikler
-
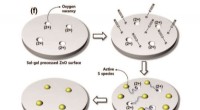 Realisering af farvefilterfri billedsensorerSkematisk mekanisme for S-doping af sol-gel-behandlet ZnO-film. Spin-coated thiocyanation (SCN?) omdannes til aktive S arter ved varmebehandling og migreres til ilt ledige steder ved elektrostatisk kr
Realisering af farvefilterfri billedsensorerSkematisk mekanisme for S-doping af sol-gel-behandlet ZnO-film. Spin-coated thiocyanation (SCN?) omdannes til aktive S arter ved varmebehandling og migreres til ilt ledige steder ved elektrostatisk kr -
 En termisk isoleringskomposit af hule silicapartikler blandet med cellulosefibreORNL-forskere lavede en termisk isoleringskomposit af hule silicapartikler ved at blande partiklerne med cellulosefibre. Kompositten viste sig at være meget fugtstabil og udviser potentiale for anvend
En termisk isoleringskomposit af hule silicapartikler blandet med cellulosefibreORNL-forskere lavede en termisk isoleringskomposit af hule silicapartikler ved at blande partiklerne med cellulosefibre. Kompositten viste sig at være meget fugtstabil og udviser potentiale for anvend -
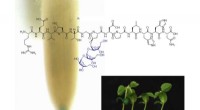 Modificerede peptider kunne booste plantevækst og udviklingNy undersøgelse viser, at peptider kan manipulere plantevækst, fører til højere udbytte. Kredit:Dr Brett Ferguson En ny australsk undersøgelse af peptidhormoner, der er kritiske for planteudviklin
Modificerede peptider kunne booste plantevækst og udviklingNy undersøgelse viser, at peptider kan manipulere plantevækst, fører til højere udbytte. Kredit:Dr Brett Ferguson En ny australsk undersøgelse af peptidhormoner, der er kritiske for planteudviklin -
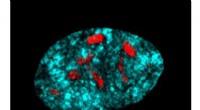 Beskyttelse af ribosomgener for at forhindre aldringI mangel af SIRT7, en menneskelig primærcelle viser flere nucleoli. DNA blev farvet med DAPI (turkis), og nucleolus blev farvet med anti-fibrillarin (rød). Kredit:Silvana Paredes Aldring er en pro
Beskyttelse af ribosomgener for at forhindre aldringI mangel af SIRT7, en menneskelig primærcelle viser flere nucleoli. DNA blev farvet med DAPI (turkis), og nucleolus blev farvet med anti-fibrillarin (rød). Kredit:Silvana Paredes Aldring er en pro
- Var Tyrannosaurus rex et rovdyr eller ådselæder?
- Hvad er det højere bjerg i verden?
- Et system til at generere nye sangtekster, der matcher stilen hos specifikke kunstnere
- Billede:Røntgenkilder i XMM-Newtons andet katalog
- Hvilket år blev nebular-teorien opdaget?
- Sådan konverteres ampere til elektroner pr. Sekund


