Hvilken type binding har den største forskel i elektronegativitet?
Her er hvorfor:
* Elektronegativitet: Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner i en binding.
* ioniske bindinger: Ioniske bindinger dannes mellem atomer med en stor forskel i elektronegativitet (typisk større end 1,7). Det mere elektronegative atom stjæler effektivt elektronet fra det mindre elektronegative atom, hvilket resulterer i dannelsen af ioner (ladede partikler).
* kovalente obligationer: Kovalente bindinger dannes mellem atomer med lignende elektronegativiteter. Elektronerne deles mellem atomerne snarere end overført.
Eksempel:
* Natrium (NA) har en lav elektronegativitet, mens klor (CL) har en høj elektronegativitet. Forskellen i elektronegativitet er betydelig, hvilket fører til dannelsen af en ionisk binding. Chloratomet får et elektron til at blive Cl- (chloridion), mens natrium mister et elektron til at blive Na+ (natriumion).
Fortæl mig, hvis du gerne vil have flere eksempler eller vil udforske specifikke typer obligationer!
 Varme artikler
Varme artikler
-
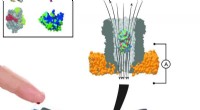 Ny metode måler enkelte molekyler fra nanoliter blod i realtidEn nanopore-enhed kan indeholde forskellige bindingsproteiner. En gang inde i poren, disse proteiner fungerer som transducere til at identificere specifikke små molekyler i en prøve af kropsvæske. Kre
Ny metode måler enkelte molekyler fra nanoliter blod i realtidEn nanopore-enhed kan indeholde forskellige bindingsproteiner. En gang inde i poren, disse proteiner fungerer som transducere til at identificere specifikke små molekyler i en prøve af kropsvæske. Kre -
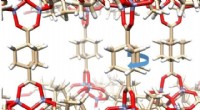 Gyroskopmolekyler danner krystal, der er både fast og fuld af bevægelseUCLA -forskere dannede en krystal ud af molekyler, der hver har et solidt ydre, men indeholder bevægelige dele. Kredit:Kendall Houk Laboratory/UCLA Molekylære maskiner, meget mindre end enkeltcell
Gyroskopmolekyler danner krystal, der er både fast og fuld af bevægelseUCLA -forskere dannede en krystal ud af molekyler, der hver har et solidt ydre, men indeholder bevægelige dele. Kredit:Kendall Houk Laboratory/UCLA Molekylære maskiner, meget mindre end enkeltcell -
 Photopower til mikrolabsKredit:Wiley-VCH Miniaturiserede enheder såsom mikrosensorer kræver ofte en uafhængig, lige så miniaturiseret strømforsyning. Søger efter passende systemer, Japanske videnskabsmænd har nu udviklet
Photopower til mikrolabsKredit:Wiley-VCH Miniaturiserede enheder såsom mikrosensorer kræver ofte en uafhængig, lige så miniaturiseret strømforsyning. Søger efter passende systemer, Japanske videnskabsmænd har nu udviklet -
 Forskere udvikler en ny kombineret proces til 3D-printInde i det 3-D-printede materiale (til højre) indeholder en gitterstruktur (til venstre) de tilsatte væsker. Kredit:Harald Rupp/Uni Halle Kemikere ved Martin Luther University Halle-Wittenberg (ML
Forskere udvikler en ny kombineret proces til 3D-printInde i det 3-D-printede materiale (til højre) indeholder en gitterstruktur (til venstre) de tilsatte væsker. Kredit:Harald Rupp/Uni Halle Kemikere ved Martin Luther University Halle-Wittenberg (ML
- Hvad er de 3 mest almindelige elementer i menneskelige organer?
- Hvad er fordele og ulemper ved vandenergi?
- Hvad er nogle produkter fremstillet af bregner, og hvordan blev de dannet?
- Er følelsesmæssig intelligens en bedre indikator for hjernens sundhed end IQ?
- Hvordan man læser en vandmands sind
- Hvordan kan du adskille blandingen af sukker og kamfer?


