Hvilke typer elementer er involveret i en ikke -polær binding?
Her er en sammenbrud:
* Samme element: Atomer med samme element har identiske elektronegativitetsværdier. Da der ikke er nogen forskel i deres evne til at tiltrække elektroner, er de delte elektroner lige fordelt mellem dem. Dette resulterer i en perfekt afbalanceret binding, og dermed ikke -polær. Eksempler:H-H (brintgas), O =O (iltgas), CL-CL (klorgas).
* Lignende elektronegativitet: Når to atomer af forskellige elementer har meget ens elektronegativitetsværdier, er forskellen i deres evne til at tiltrække elektroner ubetydelig. Dette resulterer i en binding, hvor de delte elektroner næsten er fordelt, hvilket gør bindingen effektivt ikke -polær. Eksempler:C-H (i metan), C-C (i kulbrinter).
Vigtig note: "Meget lignende" elektronegativitet er et relativt udtryk. Der er ikke noget strengt afskæringspunkt. En forskel i elektronegativitet på mindre end 0,5 betragtes generelt som en ikke -polær binding.
Sidste artikelHvilken er den tredje mest reaktive halogen?
Næste artikelObligationer, hvor elektroner er lige så delt?
 Varme artikler
Varme artikler
-
 Mat lokkemad, kroger og ødelægger forurenende stoffer i vandPletter af titaniumdioxid klæber til polyvinylfibre i en måtte udviklet på det Rice University-ledede NEWT Center for at opfange og ødelægge forurenende stoffer fra spildevand eller drikkevand. Efter
Mat lokkemad, kroger og ødelægger forurenende stoffer i vandPletter af titaniumdioxid klæber til polyvinylfibre i en måtte udviklet på det Rice University-ledede NEWT Center for at opfange og ødelægge forurenende stoffer fra spildevand eller drikkevand. Efter -
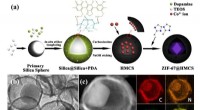 MOF@hule mesoporøse kulstofsfærer som bifunktionelle elektrokatalysatorer(a) Skematisk illustration af syntetisk procedure for ZIF@HMCS. (b) TEM-billede af ZIF@HMCS-25%. (c) HAADF-STEM-billeder og EDS-kortlægninger af ZIF@HMCS-25%. Kredit:©Science China Press Med den h
MOF@hule mesoporøse kulstofsfærer som bifunktionelle elektrokatalysatorer(a) Skematisk illustration af syntetisk procedure for ZIF@HMCS. (b) TEM-billede af ZIF@HMCS-25%. (c) HAADF-STEM-billeder og EDS-kortlægninger af ZIF@HMCS-25%. Kredit:©Science China Press Med den h -
 En lavtemperaturmetode til fremstilling af højtydende termoelektriske materialerMohamad Nugraha (til venstre) og hans gruppeleder, Derya Baran, demonstrere enhedens fleksibilitet. Kredit:KAUST Noget af den enorme mængde spildte energi, som maskiner og enheder udsender som var
En lavtemperaturmetode til fremstilling af højtydende termoelektriske materialerMohamad Nugraha (til venstre) og hans gruppeleder, Derya Baran, demonstrere enhedens fleksibilitet. Kredit:KAUST Noget af den enorme mængde spildte energi, som maskiner og enheder udsender som var -
 Oxidsintring ved lufttrykskontrolOpstilling af en prøve i en lufttryksreguleringsatmosfæreovn. Kredit:Toyohashi University of Technology Professor Hiromi Nakano fra Toyohashi University of Technology har samarbejdet med en virkso
Oxidsintring ved lufttrykskontrolOpstilling af en prøve i en lufttryksreguleringsatmosfæreovn. Kredit:Toyohashi University of Technology Professor Hiromi Nakano fra Toyohashi University of Technology har samarbejdet med en virkso
- Sådan neutraliseres muriatsyre
- Akustisk energi udnyttet til at blødgøre forskydningsfortykkende væsker
- Planetbanen i Netflixs 3 Body Problem er tilfældig og kaotisk, men kunne den eksistere?
- Kina ønsker centraliseret digital valuta efter bitcoin-angreb
- Dødelig stempelpumpe:Hvordan en koloniseringsfaktor udskilles af bakterietype 4 pili
- Nyt dråbebatteri kan bane vejen for miniature bio-integrerede enheder


