Hvad angiver, hvor meget molmasse af hver reaktant der vil blive brugt op i en reaktion?
Sådan fungerer det:
* afbalanceret kemisk ligning: En afbalanceret kemisk ligning viser de relative mængder af reaktanter og produkter i en kemisk reaktion.
* støkiometriske koefficienter: Dette er numrene foran hver kemisk formel i en afbalanceret ligning. De repræsenterer antallet af mol af hvert stof, der er involveret i reaktionen.
Eksempel:
Overvej forbrænding af metan:
Ch₄ + 2o₂ → CO₂ + 2H₂O
* 1 mol metan (CH₄) reagerer med 2 mol ilt (O₂) At producere 1 mol kuldioxid (co₂) og 2 mol vand (H₂O) .
Sådan beregnes den molære masse, der er anvendt op:
1. Identificer de støkiometriske koefficienter: I eksemplet ovenfor er koefficienten for metan 1, og koefficienten for ilt er 2.
2. Bestem den molære masse for hver reaktant: Den molære masse af methan (CH₄) er 16 g/mol, og den molære masse af ilt (O₂) er 32 g/mol.
3. Multiplicer den molære masse med den støkiometriske koefficient:
* Metan:16 g/mol * 1 =16 g
* Oxygen:32 g/mol * 2 =64 g
Derfor vil 16 gram metan reagere med 64 gram ilt i denne reaktion.
Nøglepunkt: De støkiometriske koefficienter i en afbalanceret kemisk ligning er essentielle til bestemmelse af de molære masser af reaktanter, der er anvendt i en reaktion og til beregning af mængden af produkter, der vil blive dannet.
 Varme artikler
Varme artikler
-
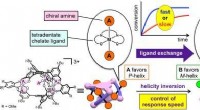 Kiralitetsinversion i et spiralformet molekyle ved kontrollerede hastighederSkema 1 fra avisen. Kredit:Kanazawa University En strategi til at invertere chiraliteten af et metalholdigt spiralformet molekyle, der kontrollerer hastigheden af responsen, er rapporteret i C
Kiralitetsinversion i et spiralformet molekyle ved kontrollerede hastighederSkema 1 fra avisen. Kredit:Kanazawa University En strategi til at invertere chiraliteten af et metalholdigt spiralformet molekyle, der kontrollerer hastigheden af responsen, er rapporteret i C -
 Dyrkning af 4-D-væv-den selvbøjede hornhindeForskere ved Newcastle University har udviklet et biologisk system, der lader celler danne en ønsket form ved at forme deres omgivende materiale-i første omgang skabe en selvbøjning af hornhinde. Hor
Dyrkning af 4-D-væv-den selvbøjede hornhindeForskere ved Newcastle University har udviklet et biologisk system, der lader celler danne en ønsket form ved at forme deres omgivende materiale-i første omgang skabe en selvbøjning af hornhinde. Hor -
 At omdanne e-affald til et stærkt, beskyttende belægning til metalMaterialet (tyk grå linje i midten af billedet) afledt af e-affald forblev intakt, når den blev indrykket, og øgede hårdheden af stålet under det. Kredit:Tilpasset fra ACS Omega 2020, DOI:10.102
At omdanne e-affald til et stærkt, beskyttende belægning til metalMaterialet (tyk grå linje i midten af billedet) afledt af e-affald forblev intakt, når den blev indrykket, og øgede hårdheden af stålet under det. Kredit:Tilpasset fra ACS Omega 2020, DOI:10.102 -
 Blomsterlignende nanostrukturer i natriumbatterierNatrium-ion-batterier (SIB) er varme kandidater til en billig og bæredygtig batteriteknologi, men et tilbagevendende problem er anode-ustabilitet. Et kinesisk hold af videnskabsmænd rapporterer nu om
Blomsterlignende nanostrukturer i natriumbatterierNatrium-ion-batterier (SIB) er varme kandidater til en billig og bæredygtig batteriteknologi, men et tilbagevendende problem er anode-ustabilitet. Et kinesisk hold af videnskabsmænd rapporterer nu om
- Hydrogenering uden brint:Effektiv katalyse i en stabil emulsionsgel
- Prototype bruger lys til at måle sammensætning, tæthed af undergrunde
- Amazons Jeff Bezos løfter sløret for en filantropisk fond på $2 mia
- Sådan fungerer militær camouflage
- Team viser, at atomer kan modtage almindelige kommunikationssignaler
- Hvorfor videnskabsklub er vigtig?


