Hvad ville øge chancen for en reaktion, når to molekyler kolliderer?
1. Øget koncentration: Højere koncentrationer af reaktanter betyder, at flere molekyler er til stede i et givet volumen, hvilket øger hyppigheden af kollisioner.
2. Øget temperatur: Højere temperaturer fører til hurtigere bevægende molekyler, hvilket resulterer i flere kollisioner med højere energi. Denne øgede energi er ofte afgørende for at overvinde aktiveringsenergibarrieren for, at reaktionen kan forekomme.
3. Øget overfladeareal: For reaktioner, der involverer faste stoffer, udsætter et større overfladeareal flere reaktantmolekyler, hvilket øger chancen for kollisioner.
4. Tilstedeværelse af en katalysator: En katalysator giver en alternativ reaktionsvej med en lavere aktiveringsenergi, hvilket gør det muligt for flere kollisioner at resultere i vellykkede reaktioner.
5. Korrekt orientering: Selv med tilstrækkelig energi skal molekyler kollidere i den korrekte orientering for, at bindinger skal bryde og dannes korrekt. Dette er ofte en begrænsende faktor i reaktioner.
6. Fysisk agitation eller blanding: Omrøring eller rysten af en reaktionsblanding hjælper med at bringe reaktanter i kontakt oftere, hvilket øger kollisionshastighederne.
7. Brug af et opløsningsmiddel: Et passende opløsningsmiddel kan opløse reaktanter, bringe dem tættere sammen og lette kollisioner.
8. Fjernelse af produkter: Fjernelse af produkter, når de dannes, kan flytte ligevægten mod dannelsen af flere produkter, hvilket øger den samlede reaktionshastighed.
9. Brug af tryk (til gasser): Stigende tryk i en gasformig reaktion øger koncentrationen af molekyler, hvilket fører til hyppigere kollisioner.
Det er vigtigt at bemærke, at disse faktorer ofte fungerer sammen, og deres kombinerede effekt bestemmer den samlede reaktionshastighed.
Sidste artikelHvad vil der ske for at bringe et stof fra flydende gas?
Næste artikelHvilken væske kan opløst faststofmateriale?
 Varme artikler
Varme artikler
-
 En chip til at måle vakuumKredit:Ecole Polytechnique Federale de Lausanne Støvsugere er en vital del af de processer - såsom frysetørring - der bruges til at fremstille og konservere utallige hverdagsting og skal måles med
En chip til at måle vakuumKredit:Ecole Polytechnique Federale de Lausanne Støvsugere er en vital del af de processer - såsom frysetørring - der bruges til at fremstille og konservere utallige hverdagsting og skal måles med -
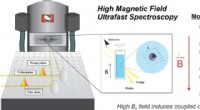 Scholes finder en ny magnetfelteffekt i diamagnetiske molekylerPrinceton University Department of Chemistry offentliggør forskning i denne uge, der beviser, at et anvendt magnetfelt vil interagere med den elektroniske struktur af svagt-magnetisk, eller diamagneti
Scholes finder en ny magnetfelteffekt i diamagnetiske molekylerPrinceton University Department of Chemistry offentliggør forskning i denne uge, der beviser, at et anvendt magnetfelt vil interagere med den elektroniske struktur af svagt-magnetisk, eller diamagneti -
 En alternativ vej til at studere de iboende egenskaber af faststofmaterialerEnhed i mikroskala fremstillet af polykrystallinsk TaGeIr:(a) scanningselektronmikroskopi af syntetiseret prøve med enkeltfasede områder af TaGeIr (orange rektangler), b) mikroskalaanordning til resis
En alternativ vej til at studere de iboende egenskaber af faststofmaterialerEnhed i mikroskala fremstillet af polykrystallinsk TaGeIr:(a) scanningselektronmikroskopi af syntetiseret prøve med enkeltfasede områder af TaGeIr (orange rektangler), b) mikroskalaanordning til resis -
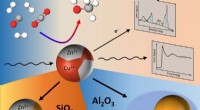 Zinkoxid:Nøglekomponent til methanolsyntesereaktionen over kobberkatalysatorerBimetalliske kobber-zink nanopartikler omdanner CO, CO2 og H2 til methanol. Kredit:© FHI/Kordus Den nuværende kommercielle produktion af methanol gennem hydrogenering af drivhusgassen CO 2 bygge
Zinkoxid:Nøglekomponent til methanolsyntesereaktionen over kobberkatalysatorerBimetalliske kobber-zink nanopartikler omdanner CO, CO2 og H2 til methanol. Kredit:© FHI/Kordus Den nuværende kommercielle produktion af methanol gennem hydrogenering af drivhusgassen CO 2 bygge


