Hvis du afkøler opløsningen langsomt, og sukker ikke sætter sig ud, som den afkøles ved, er det?
* mætning: En mættet opløsning er en, hvor opløsningsmidlet (som vand) ikke kan opløses mere opløst (som sukker) ved en given temperatur. Ethvert ekstra opløst stof vil bare slå sig ned.
* overmætning: En overmættet opløsning indeholder * mere * opløst opløst stof end en mættet opløsning ved den samme temperatur. Dette er en ustabil tilstand, og det ekstra opløselige ønsker at komme ud af løsningen.
Hvorfor sukker muligvis ikke udlignet, når det afkøles langsomt:
* langsom afkøling: Hvis du afkøler opløsningen langsomt, har sukkermolekylerne mere tid til at justere og forblive opløst. Dette skyldes, at den hastighed, hvormed sukkermolekylerne kan komme ud af opløsningen og krystalliseres, er langsom.
* Krystallisation: For at sukker kommer ud af opløsningen, skal det danne krystaller. Denne proces kan være vanskelig, hvis sukkermolekylerne er godt spredte, og der er ikke mange nucleationssteder (punkter, hvor krystaller kan begynde at dannes).
Sådan får du sukkeret til at slå sig ud:
* Tilføj en frøkrystall: At introducere en lille krystal af sukker kan fungere som et nucleationssted og udløse krystallisation.
* Skrab siden af beholderen: Dette kan skabe ufuldkommenheder på overfladen, som også kan tjene som nucleation -steder.
* Hurtig afkøling: Hurtig køling kan chokere opløsningen, hvilket gør den sværere for sukkeret at forblive opløst.
Fortæl mig, hvis du gerne vil lære mere om overmættede løsninger!
 Varme artikler
Varme artikler
-
 Kemikere skaber vedvarende plantebaserede polymererMekanisk behandling af mitranol-baserede polymerer:a - primær polymer som hvidt pulver; b - smeltet polymer, c-f - forskellige former for polymeren efter at være blevet smeltet gentagne gange. Kredit:
Kemikere skaber vedvarende plantebaserede polymererMekanisk behandling af mitranol-baserede polymerer:a - primær polymer som hvidt pulver; b - smeltet polymer, c-f - forskellige former for polymeren efter at være blevet smeltet gentagne gange. Kredit: -
 Team udvikler foldbar og vaskbar selvlysende filmDen 3D-konceptuelle illustration af den selvlysende film. Kredit:Korea Institute of Science and Technology (KIST) Infrarød stråling, som er usynlig, men alligevel meget anvendelig, bruges på forsk
Team udvikler foldbar og vaskbar selvlysende filmDen 3D-konceptuelle illustration af den selvlysende film. Kredit:Korea Institute of Science and Technology (KIST) Infrarød stråling, som er usynlig, men alligevel meget anvendelig, bruges på forsk -
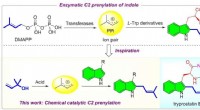 Bioinspireret syrekatalyseret C2-prenylering af indolderivaterBiomimetisk katalyse er et nyt begreb, der efterligner nøglefunktioner i enzymatisk proces. Prenylering er en allestedsnærværende proces, der findes i næsten alle levende organismer. Inspireret af den
Bioinspireret syrekatalyseret C2-prenylering af indolderivaterBiomimetisk katalyse er et nyt begreb, der efterligner nøglefunktioner i enzymatisk proces. Prenylering er en allestedsnærværende proces, der findes i næsten alle levende organismer. Inspireret af den -
 Forskere forbedrer metoden til at genbruge og forny brugte katoder fra lithium-ion-batterierNanoingeniørprofessor Zheng Chen holder hætteglas med genbrugte katodepartikler. Kredit:UC San Diego Jacobs School of Engineering Forskere ved University of California San Diego har forbedret dere
Forskere forbedrer metoden til at genbruge og forny brugte katoder fra lithium-ion-batterierNanoingeniørprofessor Zheng Chen holder hætteglas med genbrugte katodepartikler. Kredit:UC San Diego Jacobs School of Engineering Forskere ved University of California San Diego har forbedret dere


