Hvad beskriver bedst entropiændringerne i gasreaktioner?
* Øget molekylær frihed: Gasser har meget større bevægelsesfrihed sammenlignet med væsker eller faste stoffer. De har mere translationelle, roterende og vibrationsgrader af frihed. Reaktioner, der producerer flere gasmolekyler, eller hvor gasmolekyler dannes fra mere begrænsede tilstande, fører generelt til en stigning i entropi.
* Volumenudvidelse: Reaktioner, der producerer mere mol gasmolekyler, fører til en større volumenudvidelse. Denne ekspansion øger antallet af mulige mikrostater (arrangementer) for systemet, hvilket resulterer i højere entropi.
Eksempler:
* forbrænding af metan: CH4 (G) + 2O2 (G) → CO2 (G) + 2H2O (G)
* Mens produkterne har færre mol gas, fører dannelsen af vanddamp (som er gasformigt ved høje temperaturer) til en nettoforøgelse i entropi på grund af den øgede molekylære frihed og volumenudvidelse.
* nedbrydning af calciumcarbonat: CACO3 (S) → CAO (S) + CO2 (G)
* Dannelsen af gasformig CO2 fra den faste reaktant øger systemets entropi.
Vigtige overvejelser:
* Undtagelser: Nogle reaktioner kan have et fald i entropi, hvis produkterne er mere bestilt end reaktanterne, selvom de involverer gasser. For eksempel dimeriseringen af en gas til dannelse af et større molekyle.
* Temperatur: Entropiændringer påvirkes også af temperatur. Ved højere temperaturer har gasmolekylerne større kinetisk energi og øger deres entropi.
Kortfattet:
Entropiændringer i gasreaktioner drives primært af stigningen i molekylær frihed og volumenudvidelse, der opstår, når der produceres flere gasmolekyler. Mens der findes undtagelser, er den generelle tendens mod en stigning i entropi.
 Varme artikler
Varme artikler
-
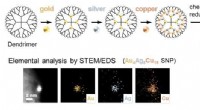 Sub-nanopartikelkatalysatorer fremstillet af møntelementer som effektive katalysatorerSkabelonsyntesen af møntmetallegerede SNPer ved hjælp af atomhybridiseringsmetoden. Tre metalelementer (guld, sølv, kobber) blandes her i en SNP på en en-nanometer skala. Kredit:Tokyo Institute of T
Sub-nanopartikelkatalysatorer fremstillet af møntelementer som effektive katalysatorerSkabelonsyntesen af møntmetallegerede SNPer ved hjælp af atomhybridiseringsmetoden. Tre metalelementer (guld, sølv, kobber) blandes her i en SNP på en en-nanometer skala. Kredit:Tokyo Institute of T -
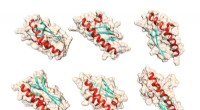 Fødslen af et nyt proteinMulige former for gærproteinet Bsc4, som computeralgoritmen QUARK forudsagde ved kun at bruge proteinets aminosyresekvenser. Kredit:Matthew Cordes, ved hjælp af UCSF Chimera molekylær grafikpakke
Fødslen af et nyt proteinMulige former for gærproteinet Bsc4, som computeralgoritmen QUARK forudsagde ved kun at bruge proteinets aminosyresekvenser. Kredit:Matthew Cordes, ved hjælp af UCSF Chimera molekylær grafikpakke -
 Lys tænkning fører til gennembrud inden for detektion af nuklear trusselSandia National Laboratories forsker Patrick Feng, venstre, holder en transstilbenscintillator og Joey Carlson holder en scintillator lavet af organisk glas. Trans-stilbenen er en størrelsesorden dyre
Lys tænkning fører til gennembrud inden for detektion af nuklear trusselSandia National Laboratories forsker Patrick Feng, venstre, holder en transstilbenscintillator og Joey Carlson holder en scintillator lavet af organisk glas. Trans-stilbenen er en størrelsesorden dyre -
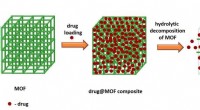 Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu
Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu


