Bindinger er polære, når forskellen i elektronegativ af atomer er end 1,7. Med en atom, der tegner elektroner mod sig selv?
obligationer er polære, når forskellen i elektronegativitet af atomer er Større end 1,7, med en atom, der tegner elektroner mod sig selv.
Her er hvorfor:
* Elektronegativitet: Dette er et mål for et atoms evne til at tiltrække elektroner i en binding. Atomer med højere elektronegativitet vil trække elektroner tættere på sig selv.
* polære obligationer: Når der er en signifikant forskel i elektronegativitet mellem to atomer, deles elektronerne ikke lige. Dette skaber en delvis positiv ladning på det mindre elektronegative atom og en delvis negativ ladning på det mere elektronegative atom.
* 1,7 tærskel: Mens 1,7 -værdien er en almindeligt citeret retningslinje, er det vigtigt at forstå, at det ikke er en streng cutoff. Nogle kilder bruger lidt forskellige værdier. Det centrale punkt er, at en større forskel i elektronegativitet fører til en mere polær binding.
Eksempel:
I et vandmolekyle (H₂O) har ilt en højere elektronegativitet end brint. Dette skaber en polær binding, hvor ilt har en delvis negativ ladning (Δ-) og hvert brint, der har en delvis positiv ladning (Δ+).
Fortæl mig, hvis du har andre kemi -spørgsmål!
Sidste artikelHvilken metaldel af borgruppen bruges til flysdele?
Næste artikelHvorfor dannes polymerer?
 Varme artikler
Varme artikler
-
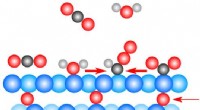 Forskere finder en overraskelse lige under overfladen i kuldioxideksperimentI denne illustration på atomare skala, spormængder af ilt (rød) lige under en kobber (blå) overflade, spiller en nøglerolle i at drive en katalytisk reaktion, hvor kuldioxid (sorte og røde molekyler)
Forskere finder en overraskelse lige under overfladen i kuldioxideksperimentI denne illustration på atomare skala, spormængder af ilt (rød) lige under en kobber (blå) overflade, spiller en nøglerolle i at drive en katalytisk reaktion, hvor kuldioxid (sorte og røde molekyler) -
 Video:Kører din brændselscellebil... på benzin?Kredit:The American Chemical Society Brintbrændselscellebiler virker som en fantastisk, lavemissionskørselsløsning:ilt og brint ind, intet andet end vanddamp ud. Men det brint skal komme fra et st
Video:Kører din brændselscellebil... på benzin?Kredit:The American Chemical Society Brintbrændselscellebiler virker som en fantastisk, lavemissionskørselsløsning:ilt og brint ind, intet andet end vanddamp ud. Men det brint skal komme fra et st -
 Nyopdaget kobber- og grafitkombination kan føre til mere effektive lithium-ion-batterierEn første af sin slags kobber- og grafitkombination, der blev opdaget i grundlæggende energiforskning ved det amerikanske energiministeriums Ames Laboratory, kunne have konsekvenser for at forbedre en
Nyopdaget kobber- og grafitkombination kan føre til mere effektive lithium-ion-batterierEn første af sin slags kobber- og grafitkombination, der blev opdaget i grundlæggende energiforskning ved det amerikanske energiministeriums Ames Laboratory, kunne have konsekvenser for at forbedre en -
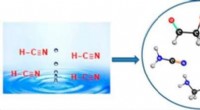 Ny indsigt i livets oprindelseKredit:American Chemical Society Et berømt forsøg i 1953 viste, at aminosyrer, byggestenene i proteiner, kunne have dannet sig spontant under de atmosfæriske forhold på den tidlige Jord. Imidlerti
Ny indsigt i livets oprindelseKredit:American Chemical Society Et berømt forsøg i 1953 viste, at aminosyrer, byggestenene i proteiner, kunne have dannet sig spontant under de atmosfæriske forhold på den tidlige Jord. Imidlerti
- Har opvarmning sat 'Dirty Dozen' forurenende stoffer tilbage i sadlen?
- Hvad er formålet med simpel destillation?
- VLA laver det første direkte billede af nøglefunktionerne i kraftfulde radiogalakser
- Er en motor, der bruger 17 ampere til meget på 20 amp sikring?
- Planteavl:Brug af usynlige kromosomer til at videregive pakker af positive egenskaber
- Optag neutrontal ved Sandia Labs Z maskinfusionsforsøg


