Har molekylerne af alkaner stærke intermolekylære kræfter og høje smeltepunkter?
* svage intermolekylære kræfter: Alkaner er ikke -polære molekyler på grund af det symmetriske arrangement af deres kulstof- og brintatomer. De eneste tilstedeværende intermolekylære kræfter er svage London -spredningskræfter (van der Waals Forces). Disse kræfter stammer fra midlertidige udsving i elektronfordeling, hvilket fører til midlertidige dipoler.
* lave smeltepunkter: Fordi de intermolekylære kræfter er svage, kræver det ikke meget energi at overvinde dem og bryde bindingerne mellem molekyler. Derfor har alkaner relativt lave smeltepunkter sammenlignet med andre typer organiske molekyler.
Nøglepunkter:
* Styrken af intermolekylære kræfter øges med størrelsen og overfladearealet af molekylet. Større alkaner vil have lidt stærkere London -spredningskræfter, hvilket fører til lidt højere smeltepunkter.
* Forgrening i alkaner reducerer overfladearealet og svækker London -spredningskræfterne, hvilket resulterer i lavere smeltepunkter.
Fortæl mig, hvis du har flere spørgsmål!
Sidste artikelHvilket element bruges en ædel gas i pærer og fotografiske billeder?
Næste artikelHvorfor har polyethylen to TG?
 Varme artikler
Varme artikler
-
 Kortlægning af ændringer i vandmolekylers dynamik og struktur i nærheden af opløste stofferMartina Havenith har hurtigt implementeret den første forskningsidé, som hun ønskede at realisere med midler fra en prestigefyldt bevilling fra Det Europæiske Forskningsråd. Kredit:RUB, Marquard K
Kortlægning af ændringer i vandmolekylers dynamik og struktur i nærheden af opløste stofferMartina Havenith har hurtigt implementeret den første forskningsidé, som hun ønskede at realisere med midler fra en prestigefyldt bevilling fra Det Europæiske Forskningsråd. Kredit:RUB, Marquard K -
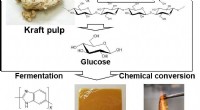 Den højeste varmebestandige plast nogensinde er udviklet af biomasseFigur 1. Udviklingsstrategi for cellulose-afledt PBI og PBI/PA film med ultrahøj termomodstand og rammehæmning. Kredit:Japan Advanced Institute of Science and Technology Brugen af biomasseafledt
Den højeste varmebestandige plast nogensinde er udviklet af biomasseFigur 1. Udviklingsstrategi for cellulose-afledt PBI og PBI/PA film med ultrahøj termomodstand og rammehæmning. Kredit:Japan Advanced Institute of Science and Technology Brugen af biomasseafledt -
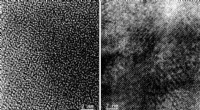 Forskere bruger en ny metode til at lave lovende batterimaterialeBilleder fremstillet ved transmissionselektronmikroskopi bekræftede transformationen af elektrodematerialet fra et uordnet arrangement af atomer (til venstre) til en ordnet, krystallinsk struktur (h
Forskere bruger en ny metode til at lave lovende batterimaterialeBilleder fremstillet ved transmissionselektronmikroskopi bekræftede transformationen af elektrodematerialet fra et uordnet arrangement af atomer (til venstre) til en ordnet, krystallinsk struktur (h -
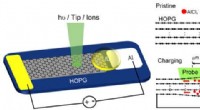 Overfladeeffekt af elektroder afsløret ved operando overfladevidenskabelige metoderSkematisk af Al/HOPG planar batteri. Kredit:@Science China Press Overflade og grænseflade spiller en afgørende rolle i energilagringsenheder, kræver derfor in-situ/operando-metoder til at sonde de
Overfladeeffekt af elektroder afsløret ved operando overfladevidenskabelige metoderSkematisk af Al/HOPG planar batteri. Kredit:@Science China Press Overflade og grænseflade spiller en afgørende rolle i energilagringsenheder, kræver derfor in-situ/operando-metoder til at sonde de
- Vandtab i de nordlige tørveområder truer med at intensivere brande, global opvarmning
- Dyreembryoner udviklede sig før dyr
- Hvordan kan vi afbøde virkningerne af støvstorme?
- Hvad understøttede teori om kontinental drift?
- Er den røde knoglemarv producerer blod?
- Hvordan klimaændringer stresser planter og ændrer deres vækst


